
题目列表(包括答案和解析)
34. (09北京卷28)(15分)
(09北京卷28)(15分)
以黄铁矿为原料生产硫酸的工艺流程图如下:
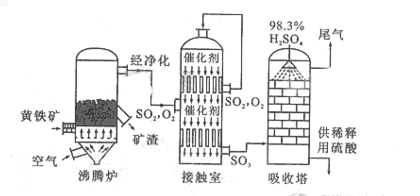
(1)将燃烧黄铁矿的化学方程式补充完整
4 +11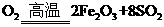
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高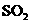 的转化率
的转化率
c. 使用催化剂能提高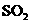 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g 气体与
气体与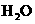 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的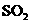 和铵盐。
和铵盐。
①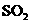 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的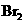 。
。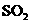 吸收
吸收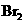 的离子方程式是
。
的离子方程式是
。
 ② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
答案:
 (1)FeS2
(1)FeS2
 (2)
(2)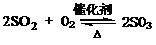
 (3)a b d
(3)a b d
 (4)SO3(g)
+ H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol
(4)SO3(g)
+ H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol
 (5)①SO2
+ Br2 + 2H2O = 4H+ + 2Br- + SO42-
(5)①SO2
+ Br2 + 2H2O = 4H+ + 2Br- + SO42-
 ②14.56 2.31g
②14.56 2.31g
33.(09北京卷26)(15分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶 。
。
II将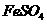 溶液与稍过量的
溶液与稍过量的 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到 固体
固体
V煅烧 ,得到
,得到 固体
固体
已知: 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的 ,该反应的离子方程式是
,该反应的离子方程式是
(2) II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3) III中,生成 的离子方程式是
。若
的离子方程式是
。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(4) IV中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 操作是是
。
操作是是
。
(5) 已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是
kg(摩尔质量/g·
的质量是
kg(摩尔质量/g·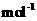 ;
; )
)
答案:
 (1)Fe + 2Fe3+ = 3Fe2+
(1)Fe + 2Fe3+ = 3Fe2+
 (2)加入硫酸,H+浓度增大,使Fe2+ + 2H2O
(2)加入硫酸,H+浓度增大,使Fe2+ + 2H2O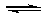 Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
 (3)Fe2+ +
2HCO3- = FeCO3↓+ CO2 ↑ + H2O
(3)Fe2+ +
2HCO3- = FeCO3↓+ CO2 ↑ + H2O
 4FeCO3 + 6H2O
+ O2 = 4Fe(OH)3 ↓+ 4CO2
4FeCO3 + 6H2O
+ O2 = 4Fe(OH)3 ↓+ 4CO2
 (4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
 (5)288.0
(5)288.0
32.(09广东化学
 19)(12分)
19)(12分)
 某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。




 (1)按图连接好实验装置。检查装置的气密性,方法是
。
(1)按图连接好实验装置。检查装置的气密性,方法是
。
 (2)反应过程中末端导管必须插入试管A的水中,目的是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
 (3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
 (4)数据记录如下:
(4)数据记录如下:


 ① 计算得到实验式CaxN2,其中x=
.
① 计算得到实验式CaxN2,其中x=
.
 ② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
 答案:
答案:
(1)关闭活塞,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,说明装置气密性良好。
 (2)防止反应过程中空气进入反应管,便于观察N2的逆流
(2)防止反应过程中空气进入反应管,便于观察N2的逆流
 (3)熄灭酒精灯,待反应管冷却至室温,停止通入氮气,并关闭活塞。
(3)熄灭酒精灯,待反应管冷却至室温,停止通入氮气,并关闭活塞。
 (4)①2.80 ②产物中生成了CaO
(4)①2.80 ②产物中生成了CaO
 解析:
解析:
(1)见答案;
(2)要保证整个装置不能混入其他气体;
(3)一定要使玻璃管冷却后再停止通入气流;
(4)要确定X值必须求出钙和氮的原子个数比根据题目给的数据可做如下计算①m(Ca)=(15.08-14.80)g=0.28g,m(N)= (15.15-15.08)g=0.07g,则n(Ca):n(N)= :=7:5,则x=;
 ②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,而Ca3N2中钙的质量分数为81.08﹪,CaO中钙的质量分数为71.43﹪,所以产物中混有了CaO会导致钙的质量分数减小,x的值偏小。
②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,而Ca3N2中钙的质量分数为81.08﹪,CaO中钙的质量分数为71.43﹪,所以产物中混有了CaO会导致钙的质量分数减小,x的值偏小。
31.(09福建卷 25)(17分)
25)(17分)
 某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验


 [实验一]收集NO气体。
[实验一]收集NO气体。
(1)
 用装置A收集NO气体,正确的操作是 (填序号)。
用装置A收集NO气体,正确的操作是 (填序号)。
 a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
a.从①口进气,用排水法集气
b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气
d..从②口进气,用排气法集气
c.从②口进气,用排水法集气
d..从②口进气,用排气法集气
 [实验二]为了探究镀锌薄铁板上的锌的质量分数
[实验二]为了探究镀锌薄铁板上的锌的质量分数 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
 (2)选用B和
(填仪器标号)两个装置进行实验。
(2)选用B和
(填仪器标号)两个装置进行实验。
 (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况), = 。
= 。
 (4)计算镀层厚度,还需要检索的一个物理量是
。
(4)计算镀层厚度,还需要检索的一个物理量是
。
 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
。
 (6)
(6) 。
。

 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
 (7)从实验误差角度分析,方案丙
方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙
方案乙(填“优于”、“劣于”或“等同于”)。
答案:
(1)C
(2)D
(3)  (或
(或 等其他合理答案:)
等其他合理答案:)
(4)金属锌的密度(或其他合理答案:)
(5)偏大
(6) (或其他合理答案:)
(或其他合理答案:)
(7)劣于
解析:
本题考查实验的探究,涉及NO气体的收集,混合物中金属含量的计算等。
(1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。
(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。
(3)Zn与H2之间量为1:1,则n(Zn)=V/22.4
mol,w (Zn)=m(Zn)/m1
=  。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。
。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。
(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。
(6)减少的质量即为Zn的质量。
(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
30.(09浙江卷 27)(15分)超音速飞机在平流层飞行时,尾气中的
27)(15分)超音速飞机在平流层飞行时,尾气中的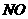 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的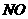 和
和 转变成
转变成 和
和 ,化学方程式如下:
,化学方程式如下:


 为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:




 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
 (1)在上述条件下反应能够自发进行,则反应的
(1)在上述条件下反应能够自发进行,则反应的 0(填写“>”、“<”、“=”。
0(填写“>”、“<”、“=”。
 (2)前2s内的平均反应速率v(N2)=_____________。
(2)前2s内的平均反应速率v(N2)=_____________。
 (3)在该温度下,反应的平衡常数K=
。
(3)在该温度下,反应的平衡常数K=
。
 (4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
 A.选用更有效的催化剂
B.升高反应体系的温度
A.选用更有效的催化剂
B.升高反应体系的温度
 C.降低反应体系的温度
D.缩小容器的体积
C.降低反应体系的温度
D.缩小容器的体积
 (5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。


 ①请在上表格中填入剩余的实验条件数据。
①请在上表格中填入剩余的实验条件数据。
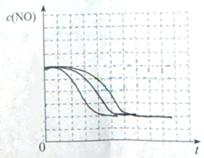
 ②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。

 答案:
答案:
(1)<
(2) 1.88×10-4mol/(L·s)
(3)5000
 (4)C、D
(4)C、D
 (5)①II: 280、1.20×10-3、5.80×10-3
(5)①II: 280、1.20×10-3、5.80×10-3
 Ⅲ:1.2×10-3 、5.80×10-3
Ⅲ:1.2×10-3 、5.80×10-3
 ②
②


 解析:
解析:
(1)自发反应,通常为放热反应,即H小于0。
(2)以NO计算,2s内NO的浓度变化为(10-2.5)×10-4mol/L,V(NO)=7.5×10-4/2 =3.75×10-4mol/(L·s)。根据速率之比等于计量系数比可知,V(N2)=1/2 V(NO)=1.875×10-4mol/(L·s)。
(3)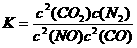 =
=

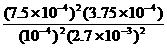 =5000。
=5000。
(4)催化剂不影响平衡的移动,A项错;该反应放热,故降温平衡正向移动,NO转化率增大,B项错,C项正确;缩小体积,即增大压强,平衡向体积减小的方向运动,即正向移动,D项正确。
 (5)本题为实验探究题,目的是研究温度和催化剂的比表面积对速率的影响,研究时只能是一个变量在起作用,所以II中数据与I比较催化剂的比表面积增大了,故其他的数据应与I完全相同;III中数据与II比较,催化剂的比表面积数据未变,但是温度升高,故其他数据是不能改变的。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。作图,可根据先拐先平的原则,即最里面的线先达平衡,速率快,应对应于III(因为其温度和催化剂的比表面积是三组中最高的),II比I快,因为两组温度相同,但是II中催化剂的比表面积大。
(5)本题为实验探究题,目的是研究温度和催化剂的比表面积对速率的影响,研究时只能是一个变量在起作用,所以II中数据与I比较催化剂的比表面积增大了,故其他的数据应与I完全相同;III中数据与II比较,催化剂的比表面积数据未变,但是温度升高,故其他数据是不能改变的。实质I、II研究是催化剂的比表面积对速率的影响,II、III研究是温度对速率的影响。作图,可根据先拐先平的原则,即最里面的线先达平衡,速率快,应对应于III(因为其温度和催化剂的比表面积是三组中最高的),II比I快,因为两组温度相同,但是II中催化剂的比表面积大。
29.(09江苏卷 20)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
20)(10分)联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
 (1)已知:2NO2(g)=====N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
(1)已知:2NO2(g)=====N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。
N2O4(g)达到平衡。
 其他条件不变时,下列措施能提高NO2转化率的是
(填字幕)
其他条件不变时,下列措施能提高NO2转化率的是
(填字幕)
 A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度
D.升高温度
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度
D.升高温度
 (2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H= kJ·mol-1
 (3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300 mol·L-1、c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
 (4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2H4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
 答案:
答案:
 (1)BC
(1)BC
 (2)-1224.96
(2)-1224.96
 (3)根据题意知平衡时:
(3)根据题意知平衡时: ;
; 
 K=
K=
 答:平衡常数为13.3。
答:平衡常数为13.3。
 (4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中:
(4)由(3)可知,在17℃、1.01×105Pa达到平衡时,1.00L混合气体中:




 则
则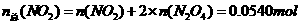
 由
由 ===
=== 可得
可得

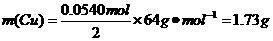

 答:理论上至少需消耗Cu 1.73
g.
答:理论上至少需消耗Cu 1.73
g.
 解析:
解析:
(1 )考查影响化学平衡移动的因素
)考查影响化学平衡移动的因素
(2)简单的反应热计算要注意将质量转化为物质的量,还要注意比例关系。
(3)(4)见答案
28. (山东卷28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(山东卷28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e- 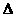 H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
 PtF6(g)+ e-1
PtF6(g)+ e-1
 PtF6-(g)
PtF6-(g) 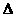 H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
 则反应O2(g)+ PtF6 (g) =
O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) =
O2+PtF6- (s)的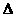 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。

 答案:
答案:
(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+
 (4)中 Kb=10-9/(
(a-0.01)mol·L-1.
(4)中 Kb=10-9/(
(a-0.01)mol·L-1.
 解析:
解析:
(1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。
(2)根据盖斯定律,将化学方程式①+②-③叠加。
(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2 的而先沉淀;由于氨水是弱碱,书写离子方程式时
不能拆开。
(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数
Kb= [c(NH4*)·c(OH-)]/c(NH3·H2O)= (0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01 mol·L-1)= 10-9/( (a-0.01)mol·L-1.
27.(09安徽卷27) (12分)
(12分)
 某厂废水中含5.00×10-3mol·L-1的
某厂废水中含5.00×10-3mol·L-1的 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁性材料 (
( 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:







 (1)第①步反应的离子方程式是
(1)第①步反应的离子方程式是
 (2)第②步中用PH试纸测定溶液PH的操作是:
(2)第②步中用PH试纸测定溶液PH的操作是:

 (3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有
 (4)欲使1L该废水中的
(4)欲使1L该废水中的 完全转化为
完全转化为 。理论上需要加入
。理论上需要加入

 GFeSO4·7H2O。
GFeSO4·7H2O。
 答案:
答案:
 (1)Cr2O72- + 6Fe2+ + 14H+
(1)Cr2O72- + 6Fe2+ + 14H+  2Cr3+ +
6Fe3+ + 7H2O
2Cr3+ +
6Fe3+ + 7H2O
 (2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
 (3)Fe(OH)3、Fe(OH)2
(3)Fe(OH)3、Fe(OH)2
 (4)13.9
(4)13.9
 解析:
解析:
(1)第①步是Cr2O72-与Fe2+发生氧化还原反应,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(2)测定溶液的pH的方法是:用玻璃棒蘸取待测溶液滴在pH试纸的中心位置,然后对照标准比色卡,读出对应颜色的数据;
(3)从最终所得磁性材料的化学式可知,滤渣中主要有Cr(OH)3、Fe(OH)2、Fe(OH)3;
(4)1L废水中的n(Cr2O72-)=5.00×10-3mol,根据关系式:Cr2O72--4Cr0.5Fe1.5FeO4-10FeSO4·7H2O,所以理论上n(FeSO4·7H2O)=0.05mol,m(FeSO4·7H2O)= 0.05mol×278g·mol-1=13.9g。
26. (09全国卷Ⅰ28)(15分)
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。

(1) 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
答案:
 (1)①正极 ②4OH--
(1)①正极 ②4OH-- 4e-=2H2O + O2↑。③2.8L ④16g ⑤甲增大,因为相当于
4e-=2H2O + O2↑。③2.8L ④16g ⑤甲增大,因为相当于 电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。
电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。
(2)可以 因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
解析:
(1)①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2  2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2
×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2
×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
25.(09全国卷Ⅱ 27)(15分)
27)(15分)

 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。

 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |


 (2) 体系中发生反应的化学方程式是___________________________;
(2) 体系中发生反应的化学方程式是___________________________;


 (3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;

 (4) 该反应达到平衡时反应物X的转化率
(4) 该反应达到平衡时反应物X的转化率 等于___________________________;
等于___________________________;

 (5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:

 ① _________________ ②________________
③__________________
① _________________ ②________________
③__________________
答案:


解析:
 本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
 (1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解
 aX +
bY
aX +
bY cZ
cZ
 开始
1.00
1.00
0
开始
1.00
1.00
0
 转化
0.45
0.9
0.9
转化
0.45
0.9
0.9
 平衡
0.55
0.1
0.9
平衡
0.55
0.1
0.9

 根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y
根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y 2Z。
2Z。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
 (4)X的转化率等于0.45。
(4)X的转化率等于0.45。
 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com