
题目列表(包括答案和解析)
9.(09广东化学 15)取五等份NO2
,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
15)取五等份NO2
,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
 2NO2(g)
2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是

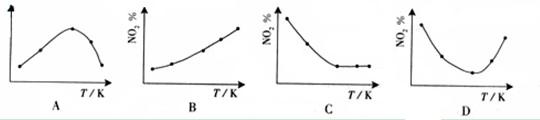
 答案:BD
答案:BD
 解析:
解析:
在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
8.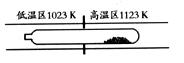 (09广东化学
(09广东化学 7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2 (s)+2I2
(g)
TaS2 (s)+2I2
(g) TaI4
(g)+S2 (g)
TaI4
(g)+S2 (g)
 下列说法正确的是
下列说法正确的是
 A.在不同温度区域,TaI4 的量保持不变
A.在不同温度区域,TaI4 的量保持不变
 B. 在提纯过程中,I2 的量不断减少
B. 在提纯过程中,I2 的量不断减少
 C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
 D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
 答案:C
答案:C
 解析:
解析:
根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。
因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误。
 根据平衡常数表达式可知K与Tal4
和S2 的浓度乘积成正比,D错误。
根据平衡常数表达式可知K与Tal4
和S2 的浓度乘积成正比,D错误。
7. (09福建卷
(09福建卷 12)某探究小组利用丙酮的溴代反应:(
12)某探究小组利用丙酮的溴代反应:(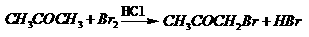 )
)
来研究反应物浓度与反应速率的关系。反应速率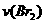 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:


 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A. 增大
A. 增大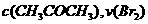 增大 B. 实验②和③的
增大 B. 实验②和③的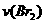 相等
相等
 C. 增大
C. 增大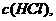
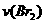 增大
D. 增大
增大
D. 增大 ,
,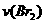 增大
增大
答案:D
解析:从表中数据看,①④中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
6.(09福建卷 10) 在一定条件下,Na2CO3溶液存在水解平衡:
10) 在一定条件下,Na2CO3溶液存在水解平衡: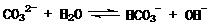 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度,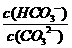 减小
减小
D. 加入NaOH固体,溶液PH减小
答案:B
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
5.(09广东理科基础 29)已知汽车尾气无害化处理反应为
29)已知汽车尾气无害化处理反应为

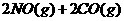

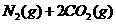
 下列说法不正确的是
下列说法不正确的是
 A.升高温度可使该反应的逆反应速率降低
A.升高温度可使该反应的逆反应速率降低
 B.使用高效催化剂可有效提高正反应速率
B.使用高效催化剂可有效提高正反应速率
 C.反应达到平衡后,N0的反应速率保持恒定
C.反应达到平衡后,N0的反应速率保持恒定
 D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
 答案:A
答案:A
 解析:
解析:
升温,无论是正反应,还是逆反应,速率均加快,A项错;催化剂可以加快化学反应速率,B项正确;达平衡后,各组分的速率保持不变,C项正确;由于CO和CO2的计量系数相等,故当两者同时消耗的量相等时,反应即达平衡,D项正确。
4.(09江苏卷 14)I2在KI溶液中存在下列平衡:
14)I2在KI溶液中存在下列平衡:

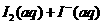

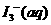
 某I2、、KI混合溶液中,
某I2、、KI混合溶液中, 的物质的量浓度c(
的物质的量浓度c( )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是


 A. 反应
A. 反应
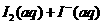

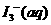 的△H>0
的△H>0
 B.若温度为
B.若温度为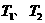 ,反应的平衡常数分别为
,反应的平衡常数分别为
 C.若反应进行到状态D时,一定有
C.若反应进行到状态D时,一定有
 D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
 答案:BC
答案:BC
 解析:
解析:
随着温度的不断升高,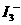 的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以
的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以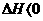 ,所以A项错;
,所以A项错;
 因为
因为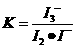 ,
,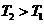 ,所以当温度升高时,反应向逆方向移动,即
,所以当温度升高时,反应向逆方向移动,即 ;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时
;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时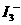 的浓度在增加,所以
的浓度在增加,所以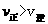 ,C项正确;
,C项正确;
D项,从状态A到状态B,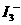 的浓度在减小,那么
的浓度在减小,那么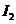 的浓度就在增加。
的浓度就在增加。
3.(09天津卷 5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
5)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO
,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO
,37 ℃时,该反应的平衡常数K=220 。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
 A.CO与HbO2反应的平衡常数K=
A.CO与HbO2反应的平衡常数K=
 B.人体吸入的CO越多,与血红蛋白结合的O2越少
B.人体吸入的CO越多,与血红蛋白结合的O2越少
 C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
 D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
 答案:C
答案:C
 解析:
解析:
 由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。K=
由反应方程式知,K的表达式正确,A对;CO与HbO2反应的平衡常数达220,可见其正向进行的程度很大,正确。K=
 ,由题意知,K=220,
,由题意知,K=220,  时,人受损,则C(CO)/C(O2)=9×10-5,C项错。D项,当O2浓度很大时,题
时,人受损,则C(CO)/C(O2)=9×10-5,C项错。D项,当O2浓度很大时,题 中平衡将逆向移动,从而解救人,正确。
中平衡将逆向移动,从而解救人,正确。
2.(09全国卷Ⅰ13)下图表示反应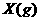

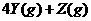 ,
, ,在某温度时
,在某温度时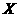 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
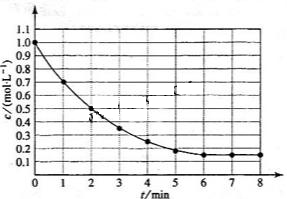
下列有关该反应的描述正确的是
A.第6 后,反应就终止了
后,反应就终止了
B.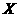 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度,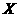 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减少
 答案:B
答案:B
 解析:
解析:
A项,6min时反应达平衡,但未停止,故错;
B项,X的变化量为1-0.15=0.85mol,转化率为0.85/1=85%,正确。
H<0,反应为放热,故升高温度 ,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故V正>V逆,即逆反应减小的倍数大,错误。
,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故V正>V逆,即逆反应减小的倍数大,错误。
1.(09安徽卷11) 汽车尾气净化中的一个反应如下:
汽车尾气净化中的一个反应如下:

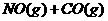

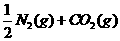
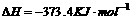
 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
 答案:C
答案:C
 解析:
解析:
该反应为气体计量数减小的放热反应,升高温度,平衡逆向移动,生成物浓度减小,反应物浓度增大,平衡常数减小,A选项错误;
同理,升高温度,平衡逆向移动,CO的转化率减小,B选项错误;
平衡常数只与热效应有关,与物质的量无关,C选项正确;
增加氮气的物质的量,平衡逆向移动,NO的转化率减小,D选项错误。
29.(2010重庆卷)(14分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下,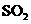 与空气反映t min后,
与空气反映t min后,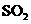 和
和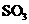 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则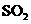 起始物质的量浓度为 mol/L ;生成
起始物质的量浓度为 mol/L ;生成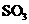 的化学反应速率为 mol/(L·min) .
的化学反应速率为 mol/(L·min) .
②工业制硫酸,尾气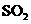 用_______吸收.
用_______吸收.
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如题29图所示.

①当左槽溶液逐渐由黄变蓝,其电极反应式为 .
②充电过程中,右槽溶液颜色逐渐由 色变为 色.
③放电过程中氢离子的作用是 和
;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为 .
1023个,左槽溶液中n(H+)的变化量为 .
29.答案(14分)
(1)① ;
;
②氨水
(2)①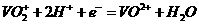
②绿 紫
③参与正极反应; 通过交换膜定向移动使电流通过溶液;0.5mol
[解析]本题考查以钒为材料的化学原理题,涉及化学反应速率和电化学知识。
(1)
由S守恒可得,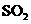 的起始浓度为(a+b)mol/L。
的起始浓度为(a+b)mol/L。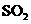 的速率为单位时间内
的速率为单位时间内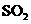 浓度的变化,即b/tmol/(L﹒min)。
浓度的变化,即b/tmol/(L﹒min)。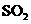 可以用碱性的氨水吸收。
可以用碱性的氨水吸收。
(2)
①左槽中,黄变蓝即为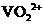 生成
生成 ,V的化合价从+5降低为+4,得一个电子,0原子减少,从图中知,其中
,V的化合价从+5降低为+4,得一个电子,0原子减少,从图中知,其中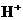 发生了移动,参与反应,由此写成电极反应式。②作为原电池,左槽得电子,而右槽失电子。充电作为电解池处理,有槽中则为得电子,对应化合价降低,即为
发生了移动,参与反应,由此写成电极反应式。②作为原电池,左槽得电子,而右槽失电子。充电作为电解池处理,有槽中则为得电子,对应化合价降低,即为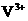 生成
生成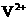 ,颜色由绿生成紫。③由电极反应式知,
,颜色由绿生成紫。③由电极反应式知,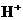 参与了反应。溶液中离子的定向移动可形成电流。n=N/NA=3.01×
参与了反应。溶液中离子的定向移动可形成电流。n=N/NA=3.01× /6.02×
/6.02× =0.5mol。
=0.5mol。
[规律总结]电化学试题的分析一般是从化合价着手,对于原电池,化合价升高的作为负极,化合价降低的作为正极,两极方程式相加即可得总反应。对于电解池,化合价升高作为阳极,降低的作为阴极。两者之间的关系是:正极反应式颠倒即为阳极反应式,负极反应式颠倒即为阴极反应式。
2009年高考化学试题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com