
题目列表(包括答案和解析)
19.(09江苏卷 17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。

 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油
B.露天焚烧
A.热裂解形成燃油
B.露天焚烧
 C.作为有机复合建筑材料的原料
D.直接填埋
C.作为有机复合建筑材料的原料
D.直接填埋
 (2)用
(2)用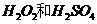 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

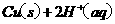 ====
====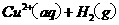
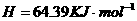

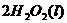 ====
====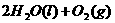
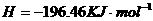

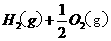 ====
====
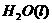
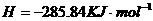
 在
在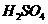 溶液中
溶液中 与
与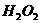 反应生成
反应生成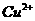 和
和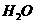 的热化学方程式为 。
的热化学方程式为 。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅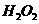 和3.0
和3.0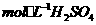 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( (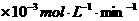 ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的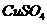 溶液中加入一定量的
溶液中加入一定量的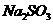 和
和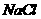 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。

 答案:
答案:
(1)BD
 (2)Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
(2)Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
 (3)H2O2
分解速率加快
(3)H2O2
分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 解析:
解析:
(1)有关环保的比较容易。
(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。
(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。
(4)根据题目条件书写离子方程式常规题。
18. (山东卷28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(山东卷28)(14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。

 (1)合成氨反应反应N2(g)+3H2(g)
(1)合成氨反应反应N2(g)+3H2(g)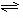 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)。
 (2)O2 (g)= O+2(g)+e-
(2)O2 (g)= O+2(g)+e- 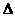 H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
 PtF6(g)+ e-1
PtF6(g)+ e-1
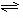 PtF6-(g)
PtF6-(g) 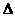 H2= - 771.1
kJ·mol-1
H2= - 771.1
kJ·mol-1
 O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6-
 H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
 则反应O2(g)+ PtF6 (g) =
O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) =
O2+PtF6- (s)的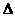 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
 (3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。
 (4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c(Cl-),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________。
 答案:
答案:
(1)向左 不改变
(2)-77.6
(3)Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+
 (4)中 Kb=10-9/(a-0.01)mol·L-1.
(4)中 Kb=10-9/(a-0.01)mol·L-1.
 解析:
解析:
(1)在恒压条件下加入氩气,则容积增大,导致原平衡中各物质的浓度同等比例减小,所以平衡向气体体积增大的方向即向左移动;催化剂仅是改变化学反应速率,不会影响焓变。
(2)根据盖斯定律,将化学方程式①+②-③叠加。
(3)Cu(OH)2 的Ksp小于Mg(OH)2的,所以离子的浓度商首先大于Cu(OH)2 的而先沉淀;由于氨水是弱碱,书写离子方程式时
不能拆开。
(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)= c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数
c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-),则有c(H*)=c(OH-),溶液显中性;电离常数只与温度有关,则此时NH3·H2O的电离常数
Kb= [c(NH4*)·c(OH-)]/c(NH3·H2O)= (0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01 mol·L-1)= 10-9/(a-0.01)mol·L-1.
17.(09安徽卷28) (17分)
(17分)
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和 浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
 [实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。

 (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
实验 编号 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
|
② |
探究温度对降解反应速率的影响 |
|
|
|
|
|
③ |
 |
298 |
10 |
6.0 |
0.30 |
 [数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
 (2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:

 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
 [解释与结论]
[解释与结论]
 (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
 (4)实验③得出的结论是:PH等于10时,
。
(4)实验③得出的结论是:PH等于10时,
。
 [思考与交流]
[思考与交流]

 (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:

 答案:
答案:
 (1)
(1)
|
实验编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
|
H2O2 |
Fe2+ |
||||
|
① |
|
|
|
|
|
|
② |
|
313 |
3 |
6.0 |
0.30 |
|
③ |
探究实验的对PH降解反应速率的影响 |
|
|
|
|

 (2)8.0×10-6
(2)8.0×10-6
 (3)过氧化氢在温度过高时迅速分解。
(3)过氧化氢在温度过高时迅速分解。
 (4)反应速率趋向于零(或该降解反应趋于停止)
(4)反应速率趋向于零(或该降解反应趋于停止)
 (5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将
(5)将所取样品迅速加入到一定量的NaOH溶液中,使pH约为10(或将 所取样品骤冷等其他合理答案均可)
所取样品骤冷等其他合理答案均可)
 解析:
解析:
(1)实验①是参照实验,所以与实验①相比,实验②和③只能改变一个条件,这样才能起到对比实验的目的,则实验②是探究温度对反应速率的影响,则T=313K,pH=3,c(H2O2)=6.0 mol·L-1,c(Fe2+)=0.30 mol·L-1,实验③显然是探究pH的大小对反应速率的影响;
(2)在50-150s内,△c(p-CP)=0.8mol·L-1,则v (p-CP)=0.08mol·L-1·s-1;(3)温度过高时,H2O2分解,c(H2O2)浓度减小,导致反应 速率减小;
速率减小;
(4)从图中看出,pH=10时,c(p-CP)不变,即反应速率为零,说明碱性条件下,有机物p-CP不能降解;
(5)从第(4)可以得出,在发言液中加入NaOH溶液,使溶液的pH迅速增大,反应停止。
16.(09全国卷Ⅱ 27)(15分)
27)(15分)

 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。

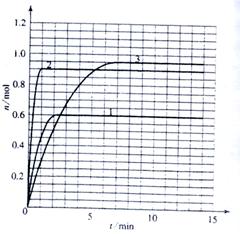
 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |


 (2) 体系中发生反应的化学方程式是___________________________;
(2) 体系中发生反应的化学方程式是___________________________;


 (3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;


 (4) 该反应达到平衡时反应物X的转化率
(4) 该反应达到平衡时反应物X的转化率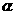 等于___________________________;
等于___________________________;

 (5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:

 ① _________________ ②________________
③__________________
① _________________ ②________________
③__________________
 答案:
答案:

 解析:
解析:
 本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
 (1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解


 开始
1.00
1.00
0
开始
1.00
1.00
0
 转化
0.45
0.9
0.9
转化
0.45
0.9
0.9
 平衡
0.55
0.1
0.9
平衡
0.55
0.1
0.9
 根据各物质的量之比可得体系中发生反应的化学方程式是:
根据各物质的量之比可得体系中发生反应的化学方程式是:

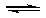
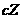 。
。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
 (4)X的转化率等于0.45。
(4)X的转化率等于0.45。

 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
15.(09宁夏卷 13)在一定温度下,反应1/2H2(g)+ 1/2X2(g)
13)在一定温度下,反应1/2H2(g)+ 1/2X2(g) 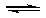 HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
 A. 5%
B. 17%
C. 25%
D.33%
A. 5%
B. 17%
C. 25%
D.33%
 答案:B
答案:B

 解析:
解析:
 1/2H2(g)+ 1/2X2(g)
1/2H2(g)+ 1/2X2(g) 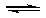 HX(g)的平衡常数K1为10,那么HX(g)
HX(g)的平衡常数K1为10,那么HX(g) 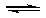 1/2H2(g)+
1/2X2(g) 的平衡常数K2为1/10, 2HX(g)
1/2H2(g)+
1/2X2(g) 的平衡常数K2为1/10, 2HX(g) 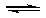 H2(g)+
X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有, 2HX(g)
H2(g)+
X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有, 2HX(g)
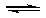 H2(g)+
X2(g)
H2(g)+
X2(g)
 1
0 0
1
0 0
 x
x x
x
x x
 1-x
x x
1-x
x x
 K3= x·x/(1-x) 2=
0.01 ,得到x=0.17,所以, 该温度时HX(g)的最大分解率接近于B. 17%
K3= x·x/(1-x) 2=
0.01 ,得到x=0.17,所以, 该温度时HX(g)的最大分解率接近于B. 17%
14.(09宁夏卷10 )硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
)硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
答案:D

 解析:
解析:
影响化学反应速率的因素众多,本题从浓度和和温度两个因素考查,非常忠实于新教材必修2,只要抓住浓度越大,温度越高反应速率越大,便可以选出正确答案D。
13. (09海南卷4
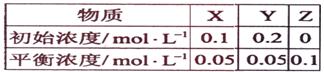
(09海南卷4 )在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

 下列说法错误的是:
下列说法错误的是:



 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
答案:C
12. (09重庆卷13)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
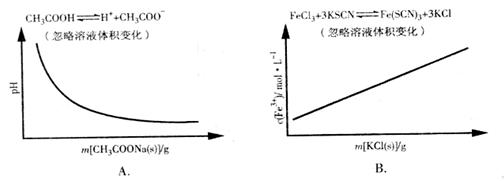
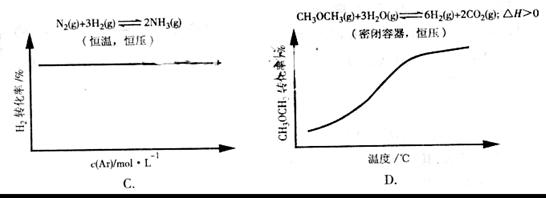
答案:D
解析:
A项CH3COOH溶液中加入CH3COONa固体,CH3COOH溶液中CH3COO-浓度增加,电离平衡逆向移动,c(H+)减小,pH逐渐增大,A错误;B项加入KCl对平衡体系无影响,化学平衡不移动,B错误;C项恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度成倍减小(等效于减压),化学平衡朝体积增大方向移动,H2的改变量减小,起始量不变,转化率减小,C错误;大暗暗选D。
11. (09四川卷13)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应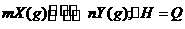 kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
 气体体积 气体体积C(Y)/mol·L-1  温度℃ 温度℃ |
1 |
2 |
3 |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.09 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
答案:C
10.(09北京卷9)已知 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入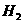 和
和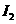 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变
D 甲增加0.1mol 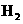 ,乙增加0.1mol
,乙增加0.1mol 
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com