
题目列表(包括答案和解析)
9.(09江苏卷 17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
17)(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
 (1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
 A.热裂解形成燃油
B.露天焚烧
A.热裂解形成燃油
B.露天焚烧
 C.作为有机复合建筑材料的原料
D.直接填埋
C.作为有机复合建筑材料的原料
D.直接填埋
 (2)用
(2)用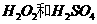 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:

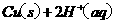 ====
====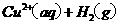


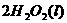 ====
====


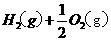 ====
====

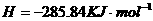
 在
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和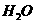 的热化学方程式为 。
的热化学方程式为 。
 (3)控制其他条件相同,印刷电路板的金属粉末用10℅
(3)控制其他条件相同,印刷电路板的金属粉末用10℅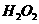 和3.0
和3.0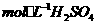 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 ( (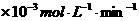 ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
 (4)在提纯后的
(4)在提纯后的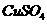 溶液中加入一定量的
溶液中加入一定量的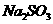 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
 答案:
答案:
(1)BD
 (2) Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-
(2) Cu(s)+H2O2
(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=- 319.68KJ.mol-1
319.68KJ.mol-1
 (3)H2O2
分解速率加快
(3)H2O2
分解速率加快
 (4)2Cu2++SO32-+2Cl-+H2O
(4)2Cu2++SO32-+2Cl-+H2O 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
 解析:
解析:
(1)有关环保的比较容易。
 (2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。
(2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。
(3)考察影响化学反应速率的因素,结合双氧水的性质即可得出答案。
(4)根据题目条件书写离子方程式常规题。
8.(09安徽卷25) (17分)
(17分)
 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
 (1)W位于元素周期表第_________周期第_________族。
(1)W位于元素周期表第_________周期第_________族。 W的气态氢化物稳定性比
W的气态氢化物稳定性比

 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。
 (2)Y的基态原子核 外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(2)Y的基态原子核 外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
 (3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
 _________________________________________________________________________。
_________________________________________________________________________。

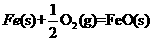
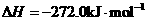


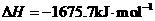
 X的单质和FeO反应的热化学方程式是_________________________________________。
X的单质和FeO反应的热化学方程式是_________________________________________。
 答案:
答案: w.w.w.k.s.
w.w.w.k.s.
(1)二 VA 弱
 (2)1s22s22p63s23p4 大
(2)1s22s22p63s23p4 大
 (3)Cu + 2H2SO4(浓)
(3)Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
 (4)3FeO(s) + 2Al(s)
(4)3FeO(s) + 2Al(s)  Al2O3(s)
+ 3Fe(s) H=-859.7KJ/mol
Al2O3(s)
+ 3Fe(s) H=-859.7KJ/mol
 解析:
解析:
 首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
7. 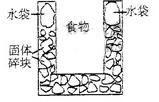 (09上海理综10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
(09上海理综10)右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是
A.硝酸铵 B.生石灰
C.氯化镁 D.食盐
答案:B
6.(09海南卷 12)已知:
12)已知:

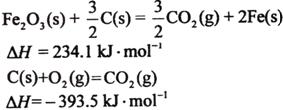



答案: A
A
1.(09全国卷Ⅱ 11) 已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
11) 已知:2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1

 CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1

 现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是

 A.1∶1
B.1∶3
A.1∶1
B.1∶3

 C.1∶4
D.2∶3
C.1∶4
D.2∶3
答案:B
解析:设H2、CH4的物质的量分别为x、ymol。则x + y =5,571.6x/2 + 890y = 3695,解得x=1.25mol; y=3.75mol,两者比为1:3,故选B项。
2.(09天津卷 6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566
kJ/mol
6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566
kJ/mol

 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
 B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2N
C.2Na2O2(s)+2CO2(s)=2N a2CO3(s)+O2(g) ΔH>-452 kJ/mol
a2CO3(s)+O2(g) ΔH>-452 kJ/mol
 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
答案:C
解析:
A项,燃烧热的单位出错,应为Kj/mol,错;图中的量标明错误,应标为2molCO和2molCO2,故错。CO2气体的能量大于固体的能量,故C项中放出的能量应小于452KJ,而H用负值表示时,则大于-452Kj/mol,正确;将下式乘以2,然后与上式相加,再除以2,即得CO与Na2O2的反应热,所得热量为57KJ,故D项错。
3. (09四川卷9)25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq) +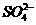 (aq)+
(aq)+ (aq)+2OH
(aq)+2OH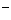 (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H O(1);
O(1);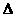 H=
H= 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+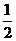 H
H SO4(aq)=
SO4(aq)= 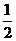 K
K SO4(aq)+H
SO4(aq)+H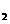 O(I);
O(I); 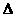 H=
H= 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+ 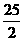 O
O (g)=8CO
(g)=8CO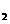 (g)+ 9H
(g)+ 9H O;
O;  H=
H= 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O (g)=16CO
(g)=16CO (g)+18H
(g)+18H O(1);
O(1);  H=
H= 5518 kJ/mol
5518 kJ/mol
 答案:B
答案:B
4.(09上海卷 19)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(
19)已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(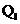 、
、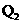 均为正值):
均为正值):


 有关上述反应的叙述正确的是
有关上述反应的叙述正确的是
 A.
A.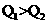
 B.生成物总能量均高于反应物总能量
B.生成物总能量均高于反应物总能量
 C.生成1molHCl气体时放出
C.生成1molHCl气体时放出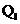 热量
热量
 D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
答案:AD
5. (09重庆卷12)下列热化学方程式数学正确的是( 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D. 2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
答案:C
解析:
A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,A项错误;
中和反应是放热反应,△H应小于0,B项错误;
热化学反应方程式要注明物质在反应时的状态,D项错误;
答案C正确
17.(2010江苏卷)(8分)下表列出了3种燃煤烟气脱硫方法的原理。

(1)
方法Ⅰ中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为:
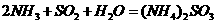
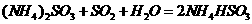
能提高燃煤烟气中 去除率的措施有 ▲ (填字母)。
去除率的措施有 ▲ (填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D. 通入空气使 转化为
转化为
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的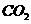 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
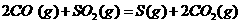


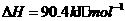
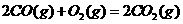

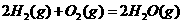
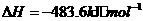
 与
与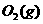 反应生成
反应生成 的热化学方程式为
。
的热化学方程式为
。
(3)
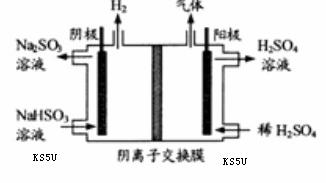
方法Ⅲ中用惰性电极电解 溶液的装置
溶液的装置
如右图所示。阳极区放出气体的成分为 。
(填化学式)
[答案]
(1)AC
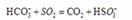
(2)S(g)+O2(g)= S O2(g) H=-574.0kJmol-1
(3) O2 SO2
[解析]本题考察的知识比较散,涉及到环境保护,一道题考察了几个知识点。覆盖面比较多。但盖斯定律、热化学方程式、离子方程式、点击方程式都是重点内容(1)提高SO2的转化率,可以增大氨水的浓度、与氨水充分接触;不需要通入CO2的原因是因为HCO3+SO2=CO2+HSO3而产生CO2 (2)主要考察盖斯定律的灵活运用。适当变形,注意反应热的计算。不要忽视热化学方程式的书写的注意事项。(3)阴极的电极产生的气体为O2和SO2.
2009年高考化学试题
25.(2010上海卷)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
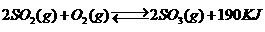
1)该反应所用的催化剂是 (填写化合物名称),该反应450℃时的平衡常数 500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是 .
a. b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molSO2,半分钟后达到平衡,测得容器中含SO30.18mol,则 = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
= mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
答案:1)五氧化二钒(V2O5);大于;2)在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;3)bd;4)0.036;向正反应方向;0.36;0.40。
解析:此题考查了工业制硫酸、化学平衡常数、热化学方程式、化学平衡状态、有关化学平衡的计算等知识。1)工业制硫酸时二氧化硫催化氧化使用的催化剂是五氧化二钒;该反应正向放热,故温度越高化学平衡常数越小;2)热化学方程式表示的是450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;3)根据化学平衡状态的特征,容器中气体的平均相对分子质量不随时间变化、分子总数不随时间变化时,说明 反应达到平衡状态;4)当达到平衡时,容器中SO3的物质的量为0.18mol,则v(SO3)=0.072mol.L-1.min-1,则v(O2)=0.036mol.L-1.min-1;再继续通入0.20molSO2和0.10molO2时,平衡向正反应方向移动,在此达到平衡时,SO3的物质的量介于0.36和0.40之间。
反应达到平衡状态;4)当达到平衡时,容器中SO3的物质的量为0.18mol,则v(SO3)=0.072mol.L-1.min-1,则v(O2)=0.036mol.L-1.min-1;再继续通入0.20molSO2和0.10molO2时,平衡向正反应方向移动,在此达到平衡时,SO3的物质的量介于0.36和0.40之间。
知识归纳:化学平衡常数只是和温度相关的函数,其随温度变化而变化。若正反应为吸热反应,温度升高K值增大;若正反应为放热反应,温度升高K值减小。
23.(2010福建卷)(15分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。
该反应的热化学方程式为________。
J。
该反应的热化学方程式为________。
解析:
(1) J元素最低负化合价的绝对值与其原子最外层电子数 相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族
相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为
(3)M和T形成的化合物为 ,与水反应
,与水反应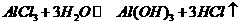 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应: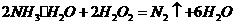
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应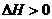 ,
,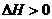 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入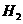 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式

答案:(1)  ;
ⅦA
;
ⅦA
(2)
(3)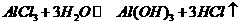 ,
,
(4)①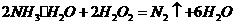
②a和c;a或c
(5)

31.(2010广东理综卷)(16分)硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3
+3H2O中,H3BO 3的转化率(
B(OCH3)3
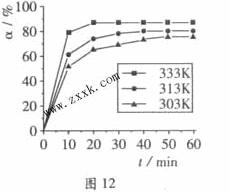
+3H2O中,H3BO 3的转化率(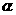 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
解析:(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
(2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。
(3) K= =
=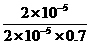 =
=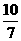
答案:
(1) B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O
(3) 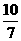 或1.43
或1.43
7.(2010天津卷)(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
解析:(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依 次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
(2) N和H 1:3构成的分子为NH3,电子式为 ;2:4构成的分子为N2H4,其结构式为
;2:4构成的分子为N2H4,其结构式为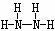 。
。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:2、8 、18、6,故其原子序数为34;其最高价氧化物对应的水化物的化学式类似H2SO4,为H2SeO4。
非金属性越强,与氢气反应放出的热量越多,故2→5周期放出的热量依次是:d、c、b、a,则第四周期的Se对应的是b。
(4)Al作阳极失去电子生成Al3+,Al3++3HCO3-==Al(OH)3+3CO2,2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
答案:
(1)O 第三周第ⅢA族 Al>C>N>O>H
(2) 
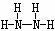
(3) 34 H2SeO4 b
(4) Al-3e- Al3+ Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3
Al3+ Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
命题立意:本题以元素的推断为背景,综合考查了元素符号的书写、元素位置的判断和原子半径大小的比较;考查了电子式、结构式的书写,元素周期律,和电极反应式、化学方程式的书写,是典型的学科内综合试题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com