
题目列表(包括答案和解析)
9.(09四川卷29)(15分)
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)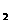 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴 极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
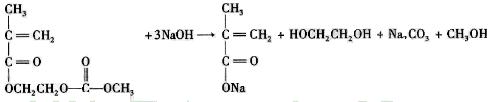
在锂郭了电池中,需要一种有机聚合物作为正负极之间锂郭子选移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
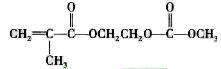
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原是 。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
(3)在方法二 中,阳极生成磷酸亚铁锂的电极反应式为
中,阳极生成磷酸亚铁锂的电极反应式为
。
(4)写出M与足量氧化钠溶液反应的化学方程式:
。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
。
答案:
(1)为了防止亚铁化合物被氧化 (3分)
(2)CO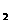 H
H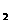 O NH3
(每空1分,共3分)
O NH3
(每空1分,共3分)
(3)Fe+H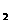 P
P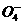 +Li+
+Li+ 2e
2e =LiFePO4+2H+
(3分)
=LiFePO4+2H+
(3分)
(4)
(3分)
(5)FePO4+Li++e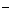 ====LiFePO4
(3分)
====LiFePO4
(3分)
8.(09天津卷 10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
10)(14分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

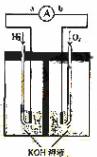 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
 (用a、b 表示)。
(用a、b 表示)。

 (2)负极反应式为 。
(2)负极反应式为 。
 (3)电极表面镀铂粉的原因为
。
(3)电极表面镀铂粉的原因为
。
 (4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
 Ⅰ.2Li+H2
Ⅰ.2Li+H2
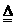 2LIH
2LIH
 Ⅱ.LiH+H2O==LiOH+H2↑
Ⅱ.LiH+H2O==LiOH+H2↑
 ①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
 ②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
 ③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。

 答案:
答案:
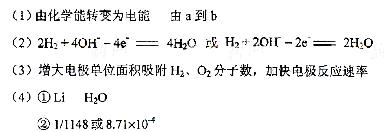
③32
 解析:
解析:
本题考查电化学知识。
(1)原电池的实质为化学能转化成电能。总反应为2H2 + O2 =2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。
(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。
(3)铂粉的接触面积大,可以加快反应速率。
 (4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)=
192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子。
(4)I.Li从零价升至+1价,作还原剂。II.H2O的H从+1降至H2中的零价,作氧化剂。由反应I,当吸收10molH2时,则生成20molLiH,V=m/ρ=20×7.9/0.82 ×10-3L=192.68×10-3L。V(LiH)/v(H2)=
192.68×10-3L/224L=8.71×10-4。20mol LiH可生成20mol H2,实际参加反应的H2为20×80%=1.6mol,1molH2转化成1molH2O,转移2mol电子,所以1.6molH2可转移3.2mol的电子。
7.(09海南卷3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
答案:A
6.(09上海卷 10)9.2g金属钠投入到足量的重水中,则产生的气体中含有
10)9.2g金属钠投入到足量的重水中,则产生的气体中含有
 A.0.2mol中子
B.0.4mol电子
A.0.2mol中子
B.0.4mol电子
 C.0.2mol质子
D.0.4mol分子
C.0.2mol质子
D.0.4mol分子
答案:B
5.(09福建卷 10) 在一定条件下,Na2CO3溶液存在水解平衡:
10) 在一定条件下,Na2CO3溶液存在水解平衡: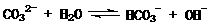 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
A. 稀释溶液,水解平衡常数增大
B. 通入CO2 ,平衡朝正反应方向移动
,平衡朝正反应方向移动
C. 升高温度,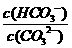 减小
减小
D. 加入NaOH固体,溶液PH减小
答案:B
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
4.(09浙江卷 12)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li
12)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为:

 Li+2Li
Li+2Li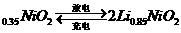
 下列说法不正确的是
下列说法不正确的是
 A.放电时,负极的电极反应式:Li-e
A.放电时,负极的电极反应式:Li-e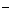 =Li
=Li
 B.充电时,Li
B.充电时,Li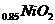 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
 C.该电池不能用水溶液作为电解质
C.该电池不能用水溶液作为电解质
 D.放电过程中Li
D.放电过程中Li 向负极移动
向负极移动

 答案:D
答案:D

 解析:
解析:
A项, Li从零价升至正价,失去电子,作为负极,正确;
B项, 反应逆向进行时。反应物只有一种,故化合价既有升,又有降,所以既发
生氧化反应又发生还原反应,正确;
C项, 由于Li可以与水反应,故应为非水材料,正确;
D项,原电池中阳离子应迁移至正极失电子,故错。
3.(09天津卷 2) 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
2) 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
 A.均存在电离平衡和水解平衡
A.均存在电离平衡和水解平衡
 B.存在的粒子种类相同
B.存在的粒子种类相同
 C.c(OH-)前者大于后者
C.c(OH-)前者大于后者
 D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大

 答案:C
答案:C
 解析:
解析:
相同浓度时,Na2CO3的碱性强于NaHCO3,C项错。
2.(09全国卷Ⅱ
 8)下列叙述中正确的是
8)下列叙述中正确的是

 A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
 和溶液,又有CaCO3沉淀生成
和溶液,又有CaCO3沉淀生成

 B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
B. 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.

 C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同

 D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出
D. 向Na2 CO3饱和溶液中通入CO2,有NaHCO3结晶析出

 答案:D
答案:D
 解析:
解析:
CaCO3与CO2反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;
向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;
等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量HCl反应时,放出的CO2多,C项错;
D项,发生的反应为:Na2CO3 + CO2 + H2O =2NaHCO3↓,由于NaHCO3的溶解性较小,故有结晶析出,正确。
1.(09全国卷Ⅰ11)为了检验某含有 杂质的
杂质的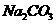 样品的纯度,现将
样品的纯度,现将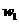 克样品加热,其质量变为
克样品加热,其质量变为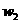 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A.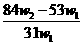
B.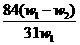
C.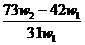
D.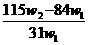
答案:A
解析:
2NaHCO3
 Na2CO3 + CO2↑ +
H2O m
(减少)
Na2CO3 + CO2↑ +
H2O m
(减少)
2×84 106 62
x (W1- w2)
解得x=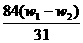 ,将其带入下式可得: w(Na2CO3)= (w1- x )/W1 =
,将其带入下式可得: w(Na2CO3)= (w1- x )/W1 = 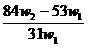 ,A项正确。
,A项正确。
20.(09宁夏卷 26)(14分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
26)(14分)碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。
 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题:
 ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式
;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式
;
 ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
 (a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)
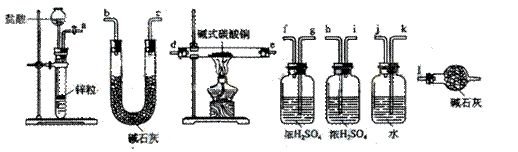








 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为
g,化学式为
;
 (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
。
 答案:
答案:
(1)①xCuCO3·yCu(OH)2·zH2O+(x+y)H 2 = (x+y)Cu+ xCO2+(x+2y+z)H2O
 ②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
②a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l
 ③1.8 CuCO3·Cu(OH)
2·H2O
③1.8 CuCO3·Cu(OH)
2·H2O
 (2)可行 根据反应xCuCO3·yCu(OH)
2·zH2O=(x+y)CuO+ xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
(2)可行 根据反应xCuCO3·yCu(OH)
2·zH2O=(x+y)CuO+ xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。

 解析:
解析:
(1)本题的碱式碳酸铜与氢气反应看似一个很难的信息,其实细心一点只要把它理解为CuCO3和Cu(OH)2受热分解后产物CuO再与氢气反应,第①问题便可以解决;对于②要能分析出测定反应后CO2和H2O质量,因此对于氢气发生器后仪器的选择是除氯化氢和水蒸气,防止对后续测定影响就可以了,因为测定H2O和CO2分别用浓硫酸和碱石灰是固定的。
(2)其实在分析(1)①方程式书写时便得到了碱式碳酸铜热分解方程式: xCuCO3·yCu(OH) 2·zH2O=(x+y)CuO+ xCO2↑+(y+z)H2O↑,稍加分析可知,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
碱金属及其化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com