
题目列表(包括答案和解析)
8.(2011北京高考9)下列与处理方法对应的反应方程式不正确的是
A.用Na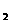 S去除废水中的Hg2+:Hg2++S2-=HgS↓
S去除废水中的Hg2+:Hg2++S2-=HgS↓
B.用催化法处理汽车尾气中的CO和NO:CO+NO C+NO2
C+NO2
C.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
D.用高温催化氧化法去除烃类废气(CxHy):
解析:S2-和Hg2+易结合形成难溶性物质,A正确;NO的氧化性强于CO,反应的方程式为
2CO+2NO N2+2CO2,因此B不正确;明矾在溶液中电离出的Al3+水解生成的氢氧化铝胶体能吸附水中的悬浮物,C正确;碳、氢化合物在高温下可被氧气氧化生成二氧化碳和水,D正确。
N2+2CO2,因此B不正确;明矾在溶液中电离出的Al3+水解生成的氢氧化铝胶体能吸附水中的悬浮物,C正确;碳、氢化合物在高温下可被氧气氧化生成二氧化碳和水,D正确。
答案:B
7.(2011江苏高考6)下列表示对应化学反应的离子方程式正确的是
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
解析:本题是基本概念中离子方程式判断正误的考查,选题以元素化合物基础和生活内容为背景。
A.电荷不守恒,离子方程式要注意三守恒(元素、电子、电荷)等。正确的方程式是:Cu+2Fe3+=Cu2++2Fe2+;
B.NO2与水的反应生成硝酸和NO,仅硝酸可折成离子。
C.用食醋除去水瓶中的水垢涉及到弱电解质及难溶物质的书写,碳酸钙、醋酸均不能拆成离子,内容来源于必修二的课本内容。正确的方程式是:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑;
D.向NaAlO2溶液中通入过量CO2的产物是Al(OH)3↓+HCO3-,本选项对部分学生有难度,但在单项选择题可以用排除法解决。正确的方程式是:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
答案:B
6.(2011上海)某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B.SO42- C. Ba2+ D.NH4+
解析:溶液显弱酸性,说明有NH4+(水解显酸性);加氯水和淀粉无明显现象排除I-、S2-。所以必需含有SO42-,故不能有Ba2+。Na+无法排除。
答案:A
5.(2011四川)甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;② 0.1mol/L乙溶液中c(H+)>0.1mol/L;③ 向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
A. 甲溶液含有Ba2+ B. 乙溶液含有SO42-
C丙溶液含有Cl- D.丁溶液哈有Mg2+
解析:可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此甲只能是Ba(OH)2;0.1mol/L乙溶液中c(H+)>0.1mol/L,什么乙是硫酸;向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,所以丁是NH4HCO3。
答案:D
4.(2011全国II卷11)将足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
解析:SiO32-与CO2反应;OH-与CO2反应;C6H5O-与CO2反应。
答案:B
3. (2011广东高考8)能在水溶液中大量共存的一组离子是
A. H+、I―、NO3―、SiO32-  B.
Ag+、Fe3+、Cl―、SO42―
B.
Ag+、Fe3+、Cl―、SO42―
C.K+、SO42-、Cu2+、NO3― D.NH4+、OH-、Cl-、HCO3-
解析:本题考察离子共存问题。SiO32-属于弱酸硅酸的酸根与酸不能大量共存,同时在酸性溶液中,NO3―具有氧化性能氧化I―生成单质碘,A不正确;Ag+与Cl―和SO42―均可生成难溶性物质AgCl和Ag2SO4,B不正确;在碱性溶液中NH4+和HCO3-均与OH-结合分别形成氨水和CO32-,因此D也不正确,所以答案是C。
答案:C
2.(2011安徽高考8)室温下,下列各组离子在指定溶液中能大量共存的是
A.饱和氯水中 Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
C.Na2S溶液中 SO42-、 K+、Cl-、Cu2+
D.pH=12的溶液中 NO3-、I-、Na+、Al3+
解析:饱和氯水具有强氧化性,能将SO32-氧化成SO42-,A中不能大量共存;c(H+)=1.0×10-13mol/L溶液,说明该溶液显碱性,因此可以大量共存;S2-和Cu2+可以结合生成难溶性CuS沉淀,所以不能大量共存;pH=12的溶液,说明该溶液显碱性,而Al3+与碱不能大量共存。所以正确的答案是B。
答案:B
1.(2011江苏高考4)常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
解析:本题以溶液中离子共存的方式考查学生对硝酸的氧化性、亚铁离子还原性、甲基橙呈红色水溶液的呈酸性、酸性溶液AlO2-不能在其中共存、与铝反应产生大量氢气有强酸碱性两种可能等相关知识的理解程度,考查学生综合运用所学化学知识解决相关化学问题的能力。
答案:C
11.(09宁夏卷 27)(15分)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
27)(15分)下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略。)
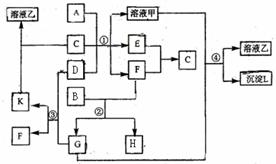




 (1)A、B、C、D代表的物质分别为
、 、 、 (填化学式);
(1)A、B、C、D代表的物质分别为
、 、 、 (填化学式);
 (2)反应①中的C、D均过量,该反应的化学方程式是 ;
(2)反应①中的C、D均过量,该反应的化学方程式是 ;

 (3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 、 (填化学式);
 (4)反应③产物中K的化学式为 ;
(4)反应③产物中K的化学式为 ;
 (5)反应④的离子方程式为 。
(5)反应④的离子方程式为 。
 答案:
答案:
(1)Al C Na2O2
(2) 2H2O +Na2O2 =4NaOH+O2↑ 2Al+ 2NaOH+2H2O=2NaAlO2+3H2↑
 (3) CO2 CO
(3) CO2 CO
(4) Na2CO3
(5) 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-

 解析:
解析:
D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3 ,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
10.(09海南卷 15)(9分)
15)(9分)
 Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。
 请回答下列问题:
请回答下列问题:
 (1)电池的负极材料为
,发生的电极反应为
;
(1)电池的负极材料为
,发生的电极反应为
;
 (2)电池正极发生的电极反应为
;
(2)电池正极发生的电极反应为
;
 (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。
如果把少量水滴到SOCl2中,实验现象是
,反应的化学方程式为
;
 (4)组装该电池必须在无水、无氧的条件下进行,原因是
。
(4)组装该电池必须在无水、无氧的条件下进行,原因是
。
答案:
 (1)锂
(1)锂
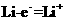 (2分)
(2分)
 (2)
(2) (2分)
(2分)
 (3)出现白雾,有刺激性气体生成
(3)出现白雾,有刺激性气体生成 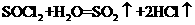 (3分)
(3分)
 (4)锂是活泼金属,易与
(4)锂是活泼金属,易与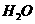 、
、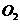 反应;
反应; 也可与水反应(2分)
也可与水反应(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com