
题目列表(包括答案和解析)
19.(2010上海卷)下列反应的离子方程式正确的是
A.苯酚与碳酸钠溶液的反应
B.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合
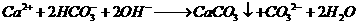
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液

D.淀粉碘化钾溶液在空气中变蓝
答案:AD
解析:此题考查了离 子方程式的正误判断。苯酚是一种具有弱酸性的有机物,故其在离子方程式中应保留化学式,生成的苯酚钠是强电解质,离子方程式正确,A对;等体积等浓度的碳酸氢钙和氢氧化钠溶液混合时,氢氧化钠不足量,离子方程式为:OH-+HCO3-+Ca2+=H2O+CaCO3↓,B错;反应前后的电荷不守恒,C错;空气中的氧气可以氧化I-为I2,其遇淀粉变蓝,D对。
子方程式的正误判断。苯酚是一种具有弱酸性的有机物,故其在离子方程式中应保留化学式,生成的苯酚钠是强电解质,离子方程式正确,A对;等体积等浓度的碳酸氢钙和氢氧化钠溶液混合时,氢氧化钠不足量,离子方程式为:OH-+HCO3-+Ca2+=H2O+CaCO3↓,B错;反应前后的电荷不守恒,C错;空气中的氧气可以氧化I-为I2,其遇淀粉变蓝,D对。
知识归纳:判断离子方程式的正误判时,关键抓住离子方程式是否符合客观事实、化学式的拆分是否准确、是否遵循电荷守恒和质量守恒、氧化还原反应中的得失电子是否守恒等;就能很好的解决问题。
9.(2010上海卷)下列离子组一定 能大量共存的是
能大量共存的是
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH一的溶液中:CO32-、Cl-、F-、K+
答案:D
解析:此题考查了化学实验中的离子共存知识。使甲基橙呈黄色的溶液pH大于4.4,当其处于4.4-7之间时,NO3-表现强氧化性,将I-氧化为I2,排除A;石蕊呈蓝色的溶液pH大于8,溶液呈碱性,OH-能和HCO3-反应,排除B;含大量Al3+的溶液中,溶液呈酸性,其中的H+能和ClO-结合成HClO,排除C。
知识归纳:在给定条件下,考查离子组能否共存时,要注意其与元素化合物知识、电离平衡知识的联系。特别要注意题干中条件的应用,比如本题中的“甲基橙呈黄色”、“石蕊呈蓝色”、“含大量的Al3+的溶液”等,倘若只分析选项中给出的离子之间能否共存,就会造成错误解答。
7.(2010广东理综卷)能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
解析:A中Ag+和PO43-、Cl-因生成沉淀不共存;B中H+和HCO3-离子生成气体不共存,Fe3+和I-因发生氧化还原反应不共存;D中Al3+和CO32-因互促水解不共存。
答案:C
9.(2010安徽卷)在pH=1的溶液中能大量共存的一组离子或分子是
A.Na+、Mg2+、ClO-、NO3- B. Al3+、 NH4+、 Br- 、Cl-
C. K+ 、Cr2O72- 、CH3CHO、 SO42- D. Na+、K+ 、SiO32-、Cl-
答案:B
解析:酸性环境下A中生成次氯酸,C中Cr2O72-氧化CH3CHO,D中生成硅酸沉淀。
5.(2010天津卷)下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
解析:B中元素不守恒,正确的离子方程式为:2Na2O2+2H2O==4Na++4OH-+O2;C中的HClO是弱酸,不能拆成离子形式;D的离子方程式本身没有问题,但KMnO4的强氧化性能将浓盐酸氧化,不能实现证明H2O2具有还原性的目的(还原性:HCl>H2O2,HCl先反应),D错。
答案:A
命题立意:考查离子方程式的正误判断。
8.(2010全国2)能正确表示下列反应的离子方程式是
A.将铜屑加入 溶液中:
溶液中:
B.将磁性氧化铁溶于盐酸: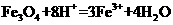
C.将氯化亚铁溶液和稀硝酸混合: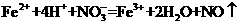
D.将铁粉加入稀硫酸中: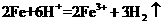
[解析]A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
[答案]A
[命题意图]考查离子方程式的正误判断方法!
[点评]离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D这是个重现率很高的的经典错误,考生绝对做过原题!B项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考题中再次出现,这道题就没什么意思了!A直接取材于课本第二册,C选项,考生也绝对做过,都是太常见不过了!
1.(2010全国卷1)能正确表示下列反应的离子方程式是
A.将铜屑加入 溶液中:
溶液中:
B.将磁性氧化铁溶于盐酸: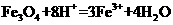
C.将氯化亚铁溶液和稀硝酸混合: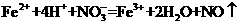
D.将铁粉加入稀硫酸中: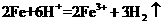
[解析]A正确,符合3个守恒;B错误,电荷不守恒,Fe3O4中Fe有两种价态,正确应该为:Fe3O4+8H+=2Fe3++Fe2++4H2O;C错误,得失电子不守恒,电荷不守恒;正确的应为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;D错误,不符合客观实际,反应后铁只能产生Fe2+和H2;
[答案]A
[命题意图]考查离子方程式的正误判断方法!
[点评]离子方程式正误判断是个老生常谈的问题了,本题出得太没有创意了,如D这是个重现率很高的的经典错误,考生绝对做过原题!B项也见得多,一般考查不是用盐酸而是用氢碘酸,有些专家多次指出,磁性氧化铁不溶于任何酸,这样的典型错误在高考题中再次出现,这道题就没什么意思了!A直接取材于课本第二册,C选项,考生也绝对做过,都是太常见不过了!
11.(2011上海21)在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A. Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓
B.NH4++Fe3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓+ Fe(OH)3↓+ NH3·H2O
C.2Fe3++ 3SO42-+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓
D.3NH4++ Fe3++3SO42-+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)3↓+3NH3·H2O
解析;复盐NH4Fe(SO4)2中Fe的化合价是+3价,因此选项A不正确;又因为NH4Fe(SO4)2还可以形成(NH4)2SO4·Fe2(SO4)3的形式,因此当Ba(OH)2不足时选项C也有可能发生。
答案:BC
2010年高考
10. (2011海南)下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. KClO3和K2SO4 D. Na2SO3和BaCO3
[答案]D
命题立意:基本化学性质化学反应的考查
解析:根据题中的要求,要产生气泡同时有沉淀生成。A选项无沉淀生成,B选项无气体生成,C选项物质不熟悉可用排除法,D可得到气体和沉淀,符合题目要求。
[技巧点拨]关于物质性质考查的题,通常出现在单选题中。如果选项中有不熟悉的物质,一般用排除法处理,以防解题出错。
9.(2011新课标全国)能正确表示下列反应的离子方程式为
A. 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
C. 少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O=C6H5OH+HSO3-
D. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2 +H2O
+H2O
解析:硝酸具有氧化性,能 氧化FeS,因此产物应该是硝酸铁、硫酸和一氧化氮,A不正确;NH4HCO3溶于过量的NaOH溶液中除了生成碳酸钠外还有氨气生成,方程式为:
氧化FeS,因此产物应该是硝酸铁、硫酸和一氧化氮,A不正确;NH4HCO3溶于过量的NaOH溶液中除了生成碳酸钠外还有氨气生成,方程式为:
NH4++HCO3-+2OH-=CO32-+2H2O+NH3↑,B不正确;SO2不足产物应该是SO32-,C不正确。所以答案是D。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com