
题目列表(包括答案和解析)
11.(09福建卷 10) 在一定条件下,Na2CO3溶液存在水解平衡:
10) 在一定条件下,Na2CO3溶液存在水解平衡: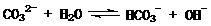 。下列说法正确的是
。下列说法正确的是
 A. 稀释溶液,水解平衡常数增大
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡朝正反应方向移动
C. 升高温度, 减小
减小

D. 加入NaOH固体,溶液PH减小
答案:B
解析:平衡常数仅与温度有关,故稀释时是不变的,A项错;CO2通入水中,相当于生成H2CO3,可以与OH-反应,而促进平衡正向移动,B项正确;升温,促进水解,平衡正向移动,故表达式的结果是增大的,C项错;D项,加入NaOH,碱性肯定增强,pH增大,故错。
10. (09广东理科基础
(09广东理科基础 33)下列说法正确的是
33)下列说法正确的是
 A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红
 B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
B.Al3+、NO3- 、Cl-、CO32 -、Na+可大量共存于pH=2的溶液中
 C.乙醇和乙酸都能溶于水,都是电解质
C.乙醇和乙酸都能溶于水,都是电解质
 D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
 答案:A
答案:A
 解析:
解析:
Na2CO3溶液水解显碱性,故加入酚酞是变红的,A项正确;pH=2为酸性溶液,所以CO32 -与H+是反应的,故不能共存,B项错;乙醇属于非电解质,C项错;硫酸为二元酸,故NaOH的物质的量是HCl的两倍,D项错。
9.(09浙江卷 10)已知:25°C时,
10)已知:25°C时,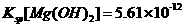 ,
,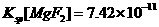 。下列说法正确的是
。下列说法正确的是
 A.25°C时,饱和
A.25°C时,饱和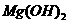 溶液与饱和
溶液与饱和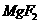 溶液相比,前者的
溶液相比,前者的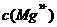 大
大
 B.25°C时,在
B.25°C时,在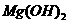 的悬浊液加入少量的
的悬浊液加入少量的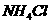 固体,
固体,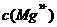 增大
增大
 C.25°C时,
C.25°C时,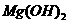 固体在20ml0.01 mol·
固体在20ml0.01 mol·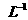 氨水中的
氨水中的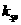 比在20mL0.01mol·
比在20mL0.01mol·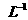
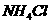 溶液中的
溶液中的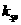 小
小
 D.25°C时,在
D.25°C时,在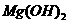 的悬浊液加入
的悬浊液加入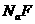 溶液后,
溶液后,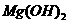 不可能转化成为
不可能转化成为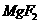
 答案:B
答案:B
 解析:
解析:
A项, Mg(OH)2的溶度积小,故其电离出的Mg2+浓度要小一些,错;
B项, NH4+ 可以结合Mg(OH)2电离出的OH-离子,从而促使Mg(OH)2的电离平衡正向移动,C(Mg2+)增大,正确。
C项, Ksp仅与温度有关,故错;
D项,由于MgF2的溶度积更小,所以沉淀会向更难溶的方向进行,即可以生成MgF2沉淀,正确。
8.(09浙江卷 9)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
9)已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是
 A.0.01mol·
A.0.01mol·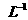 的蔗糖溶液
B. 0.01mol·
的蔗糖溶液
B. 0.01mol·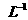 的
的 溶液
溶液
 C.0.02mol·
C.0.02mol·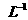 的
的 溶液
D. 0.02mol·
溶液
D. 0.02mol·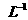 的
的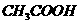 溶液
溶液
 答案:C
答案:C
 解析:
解析:
单位体积内的粒子数,实质为粒子的浓度。显然C项、D项的浓度比A项和C项的大,又C项为强电解质,完全电离,而CH3COOH为弱酸,部分电离,所以C项中粒子浓度大,故混点最高。
7.(09江苏卷 13)下列溶液中微粒的物质的量浓度关系正确的是
13)下列溶液中微粒的物质的量浓度关系正确的是
 A.室温下,向0.01
A.室温下,向0.01 溶液中滴加
溶液中滴加 溶液至中性:
溶液至中性: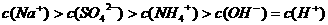
 B.0.1
B.0.1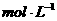
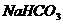 溶液:
溶液: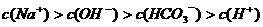
 C.
C.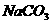 溶液:
溶液: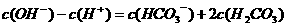
 D.25℃时,
D.25℃时,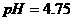 、浓度均为0.1
、浓度均为0.1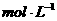 的
的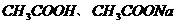 混合溶液:
混合溶液: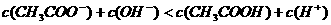
 答案:AC
答案:AC
 解析:
解析:
 B 项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3-
的浓度永大于OH-浓度,故错;
B 项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3-
的浓度永大于OH-浓度,故错;
D项,由电荷守恒有:C(CH3COO-)+C(OH-)=C(H+)+C(Na+) ,由物料守恒可得:2c(Na+)= C(CH3COO-)+ C(CH3COOH),将两式中的C(Na+) 消去,可得C(CH3COO-)+2C(OH-)=2C(H+)+ C(CH3COOH)。所以C(CH3COO-)+C(OH-) -C(H+) - C(CH3COOH)= C(H+)-C(OH-),因为pH=4.75,故C(H+)-C(OH-)>0,所以D项不等式应为”>” ,故错。
6.(09天津卷 4)下列叙述正确的是
4)下列叙述正确的是
 A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
 B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
 C.pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
C.pH=5的CH3COOH溶液和Ph=5的NH4Cl溶液中,c(H+)不相等
 D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
 答案:D
答案:D
 解析:
解析:
A项,苯酚钠为碱性溶液,故错;
B项,温度不变,则Kw是不变的,错;
C项,pH=5即代表溶液中C(H+)均为10-5mol/L,错。
D项,Ag2S比AgCl更难溶,故加入S2-会与溶液中的Ag+结合的,正确。
5. (09天津卷
(09天津卷 2) 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
2) 25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
 A.均存在电离平衡和水解平衡
A.均存在电离平衡和水解平衡
 B.存在的粒子种类相同
B.存在的粒子种类相同
 C.c(OH-)前者大于后者
C.c(OH-)前者大于后者
 D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
 答案:C
答案:C
 解析:
解析:
相同浓度时,Na2CO3的碱性强于NaHCO3,C项错。
3.(09全国卷Ⅱ
 7)下列关于溶液和胶体的叙述,正确的是
7)下列关于溶液和胶体的叙述,正确的是

 A. 溶液是电中性的,胶体是带电的
A. 溶液是电中性的,胶体是带电的

 B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动

 C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动

 D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
 答案:D
答案:D
 解析:
解析:
胶体本身是不带电,只是其表面积较大,吸附了溶液中的离子而带了电荷,故A项错;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错;布朗运动本身即是无规律的运动,C项错;丁达尔效应可以用来区分溶液和胶体,D项正确。
4.(09全国卷Ⅱ
 10)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
10)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是

 A. ④①②⑤⑥③
B. ④①②⑥⑤③
A. ④①②⑤⑥③
B. ④①②⑥⑤③

 C. ①④②⑥③⑤
D. ①④②③⑥⑤
C. ①④②⑥③⑤
D. ①④②③⑥⑤
 答案:C
答案:C
 解析:
解析:
①②④均属于酸,其中醋酸最强,碳酸次之,苯酚最弱。③⑤⑥均属于强碱弱酸盐,根据越弱越水解的原理知,因H2CO3>苯酚>HCO3- ,所以对应的盐,其碱性为:碳酸钠>苯酚钠>碳酸氢钠,pH顺序相反,故C项正确。
2.(09全国卷Ⅰ10)用0.1 mol•. 的盐酸滴定0.10 mol•.
的盐酸滴定0.10 mol•. 的氨
的氨 水,滴定过程中不可能出现的结果是
水,滴定过程中不可能出现的结果是
A.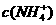 >
> ,
,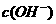 >
> B.
B. 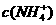 =
= ,
,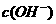 =
=
C. >
>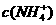 ,
,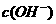 >
> D.
D.  >
>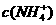 ,
, >
>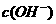
 答案:C
答案:C
 解析:
解析:
溶液中不可能出现阴离子均大于阳离子的情况,不遵循电荷守恒,故C项错。
1.(09安徽卷13) 向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
 A. Va>Vb时:c (CH3COOH) +c
(CH3COO-)>c (K+)
A. Va>Vb时:c (CH3COOH) +c
(CH3COO-)>c (K+)
 B. Va=Vb时:c (CH3COOH) +c
(H+)>c (OH-)
B. Va=Vb时:c (CH3COOH) +c
(H+)>c (OH-)
 C. Va<Vb时:c (CH3COO-)>c
(K+)> c (OH-)> c (H)
C. Va<Vb时:c (CH3COO-)>c
(K+)> c (OH-)> c (H)
 D. Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
D. Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
 答案:
答案: C
C
 解析:
解析:
 若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+
n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;
若Va>Vb,醋酸过量,根据物料守恒可知,n(CH3COOH)+
n(CH3COO-)=0.05Va,n(K+)= 0.05VVb,则A选项正确;
若Va=Vb,反应后为CH3COOK溶液,由于的CH3COO-水解而显碱性,根据质子守恒可知,B选项正确;
若Va<Vb,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;
D选项符合电荷守恒,正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com