
题目列表(包括答案和解析)
48.土壤(根系吸收);汽车尾气含铅,离公路距离不同,空气中含铅量不同
51.通过研究,小红提出了一系列降低铅对环境污染的建议,下列建议中不恰当的事()
A.使用无铅汽油
B.开发新的无铅燃料
C.倡导使用铅蓄电池作动力的电动车
D.燃煤电厂、金属冶炼厂的废气经除尘后排放。
答案:
50.在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,他设计了如下实验步骤:



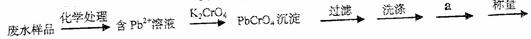
(1)步骤中过滤需要的玻璃仪器是、和玻璃棒。
(2)步骤中a操作称为,缺少此操作,测得结果(填“偏高”、“偏低”、或“无影响”)。
48.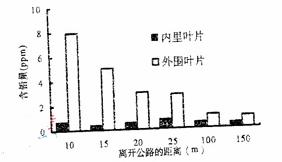 小红查阅到右图资料,图中记录了离某公路不同距离处种植的卷心菜中铅的含量。由改图推测:卷心菜内里叶片的铅可能直接来于,造成卷心菜外围叶片含铅量不同的重要原因。
小红查阅到右图资料,图中记录了离某公路不同距离处种植的卷心菜中铅的含量。由改图推测:卷心菜内里叶片的铅可能直接来于,造成卷心菜外围叶片含铅量不同的重要原因。
32.(09上海理综五)(本体14分)铅是一种重金属,相对原子量为207。铅和铅的化合物有很多用途,如蓄电池等,但铅类化合物大多有毒,燃煤厂、金属冶炼厂等都有主要的铅污染源。铅一旦进入人体会累积,对人脑、肾脏和造血功能有损害。为了了解环境中的铅污染问题,小红他同学进行了如下的研究。
31.(09宁夏卷 37)[化学-选修化学与技术](15分)
37)[化学-选修化学与技术](15分)
 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
 ①
①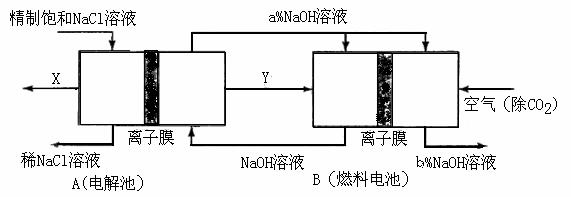 图中X、Y分别是_____、____
图中X、Y分别是_____、____ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
 答案:
答案:
(1)k=M(Cl2)/2M(NaOH)=71/80=1:1.13或0.89
(2)③①②
(3)①Cl2H2a%小于b%②O2+4e-+2H2O=4OH- H2-2e-+2OH-=2H2O③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗(其他合理答案也给分)

 解析:
解析:
(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2M(NaOH)=71/80=1:1.13或0.89;
(2)只要抓住除钡离子要放在除碳酸根离子前即可得到顺序关系:③①②;
(3)本题突破口在于B燃料电池这边,通空气一边为正极(还原反应),那么左边必然通H2,这样Y即为H2;再转到左边依据电解饱和食盐水的化学方程式可知唯一未知的就是X,必然为Cl2了;A中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O=4OH-可知NaOH+浓度增大。
30.(09海南卷 20)(20分)
20)(20分)
 20-1-20-3题为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。20-4题为非选择题,请在答题纸相应位置做答。
20-1-20-3题为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。20-4题为非选择题,请在答题纸相应位置做答。
 20-1.下列有关肥皂的叙述中错误的是:
20-1.下列有关肥皂的叙述中错误的是:



 A.肥皂与纯碱的去污原理相同
A.肥皂与纯碱的去污原理相同
 B.肥皂可以加速油污在水中的分散
B.肥皂可以加速油污在水中的分散
 C.肥皂是油脂在碱性条件下水解生成的
C.肥皂是油脂在碱性条件下水解生成的
 D.肥皂主要成分的分子中含有亲油基团和亲水基团
D.肥皂主要成分的分子中含有亲油基团和亲水基团
 20-2.下列使用化肥、农药的描述中正确的是:
20-2.下列使用化肥、农药的描述中正确的是:
 A.高温多雨时比较适合施用钾肥
A.高温多雨时比较适合施用钾肥
 B.长期施用硫铵会造成土壤板结
B.长期施用硫铵会造成土壤板结
 C.石硫合剂必须与硫酸混合后才能施用
C.石硫合剂必须与硫酸混合后才能施用
 D.过磷酸钙必须经硫酸处理后才能施用
D.过磷酸钙必须经硫酸处理后才能施用
 20-3.下列有关硬水及其软化的说法中错误的是:
20-3.下列有关硬水及其软化的说法中错误的是:
 A.离子交换法可以软化硬水
A.离子交换法可以软化硬水
 B.硬水中含有较多Ca2+、Mg2+
B.硬水中含有较多Ca2+、Mg2+
 C.生产、生活使用的天然水必须经软化
C.生产、生活使用的天然水必须经软化
 D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀
 20-4(11分)
20-4(11分)
 工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸。请回答下列问题:
 (1)氨催化氧化的化学方程式为:
(1)氨催化氧化的化学方程式为:
 (2)原料气中空气必须过量,其主要原因是;
(2)原料气中空气必须过量,其主要原因是;
 (3)将铂铑合金做成薄丝网的主要原因是;
(3)将铂铑合金做成薄丝网的主要原因是;
 (4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)
(4)水吸收二氧化氮生成硝酸为放热反应,其化学方程式为,为了提高水对二氧化氮的吸收率,可采取的措施为(答2项)
 答案:
答案:



 20-1A(3分)
20-1A(3分)
 20-2B(3分)
20-2B(3分)
 20-3C(3分)
20-3C(3分)
 20-4(11分)
20-4(11分)


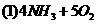
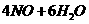 (3分)
(3分)
 (2)提高氨的转化率和一氧化氮的转化率(2分)
(2)提高氨的转化率和一氧化氮的转化率(2分)
 (3)增大单位质量的催化剂与反应物的接触面积(2分)
(3)增大单位质量的催化剂与反应物的接触面积(2分)
 (4)
(4)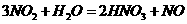 加压降温
加压降温
29.(09海南卷 14)(8分)
14)(8分)


 汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
汽车已经成为重要的交通工具,但其排放的尾气是空气的主要污染物之一。已知汽车尾气中的主要污染物有:CmHn(烃)、SO2、NOX、CO和C等,请回答下列有关问题。
 (1)若用CmHn表
(1)若用CmHn表 示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为能,最终转化为机械能;
示汽油的主要组成,CmHn在空气中完全燃烧的化学方程式为,汽油燃烧产生能量为汽车提供了动力,这一过程中能量的转化是由能转化为能,最终转化为机械能;
 (2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放;
(2)通过车用燃油的精炼加工处理,可减少汽车尾气中的(填化学式,多填本空不得分)排放;
 (3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式。
(3)目前汽车尾气多采用催化转化的方法加以治理,写出在催化剂作用下NOX与CO反应的化学方程式。
答案:
 (1)
(1)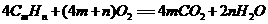 (2分)
(2分)
 化学热(2分)
化学热(2分)
 (2)
(2)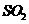 (2分)
(2分)
 (3)
(3) (2分)
(2分)
28.(09北京卷28)(15分)
以黄铁矿为原料生产硫酸的工艺流程图如下:
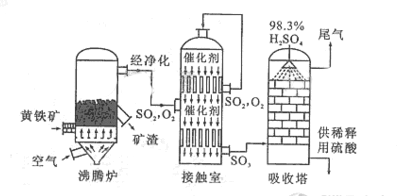
(1)将燃烧黄铁矿的化学方程式补充完整



4+11
(2)接触室中发生反应的化学方程式是。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高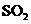 的转化率
的转化率
c.使用催化剂能提高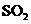 的反应速率和转化率
的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160g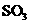 气体与
气体与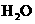 化合放出260.6kJ的热量,该反应的热化学方程是。
化合放出260.6kJ的热量,该反应的热化学方程是。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的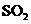 和铵盐。
和铵盐。
①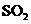 既可作为生产硫酸的原料循环再利用,也可用
既可作为生产硫酸的原料循环再利用,也可用 于工业制溴过程中吸收潮湿空气中的
于工业制溴过程中吸收潮湿空气中的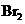 。
。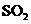 吸收
吸收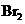 的离子方程式是。
的离子方程式是。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是%;若铵盐质量为15.00g。浓硫酸增加的质量为。(计算结果保留两位小数)
答案:
 (1)FeS2
(1)FeS2
 (2)
(2)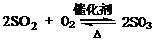
 (3)abd
(3)abd
 (4)SO3(g)+H2O(l)=H2SO4(l);ΔH=-130.3kJ/mol
(4)SO3(g)+H2O(l)=H2SO4(l);ΔH=-130.3kJ/mol
 (5)①SO2+Br2+2H2O=4H++2Br-+SO42-
(5)①SO2+Br2+2H2O=4H++2Br-+SO42-
 ②14.562.31g
②14.562.31g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com