
题目列表(包括答案和解析)
2.(2008年江苏化学)下列文字表述与反应方程式对应且正确的是 ( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:
Br-+Ag+===AgBr↓
B.用醋酸除去水垢:CaCO3+2H+===Ca2++H2O+CO2↑
C.利用腐蚀法制作印刷线路板:Fe3++Cu===Fe2++Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯:
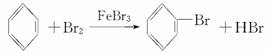
[解析] A项,溴乙烷不能电离出Br-;B项,醋酸应写化学式;C项电荷不守恒。
[答案] D
1.(2008年广东化学)下列化学反应的离子方程式正确的是 ( )
A.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
B.少量SO2通入Ca(ClO)2溶液中:
SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C.在稀氨水中通入过量CO2:
NH3·H2O+CO2===NH+HCO
D.氢氧化钙溶液与等物质的量的稀硫酸混合:
Ca2++OH-+H++SO===CaSO4↓+H2O
[解析] A项,稀HNO3能将-2价的S氧化;B项,HClO能将+4价S氧化;D项,离子方程式应为Ca2++2OH-+2H++SO===CaSO4↓+2H2O。
[答案] C
14.铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场一种常见的补铁药品。下表是其说明书中部分内容。
[规格] 每片含琥珀酸亚铁0.1 g
[适应症] 用于缺铁性贫血症的预防及治疗。
[用量用法] 成人预防量0.1 g/日,成人治疗量0.2 g/日-0.4 g/日,小儿预防量30 mg/日-60 mg/日,治疗量0.1 g/日-0.3 g/日。
[贮藏] 避光、密封、在干燥处保
(1)该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10.00%时不能再服用。
①为了检验某药店出售的“速力菲”是否被氧化,实验室应选用的检验试剂为________________(填试剂的名称);
②实验室可采用的H2SO4酸化的KMnO4溶液,对“速力菲”的Fe2+进行滴定(假设药品中,其他成分不与KMnO4反应)。请配平下列离子方程式:____MnO+______Fe2++______H+―→______Mn2++______Fe3++______H2O;
③称量上述含铁元素质量分数为20.00%的“速力菲”10.00 g,将其全部溶于稀H2SO4中,配制成1 000.00 mL溶液,取出20.00 mL,用0.01 mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00 mL。该药品可以服用吗?______(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)_____________________________________ _____
________________________________________________________________________
________________________________________________________________________。
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸。含23.6 g琥珀酸的溶液与4.0 mol/L 100.00 mL的氢氧化钠溶液恰好完全中和。质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子。写出琥珀酸溶液与氢氧化钠溶液完全中和的化学方程式(有机物写结构简式)______________________________________________,琥珀酸亚铁的化学式为__________________。
[解析] (2)假设琥珀酸分子中含有一个Fe2+,则琥珀酸为二元羧酸,根据琥珀酸亚铁的相对分子质量为172,得琥珀酸的相对分子质量为118,23.6 g(0.2 mol)琥珀酸恰好与含有0.4 mol 的NaOH溶液反应,说明假设成立。琥珀酸中只有两种位置不同的H原子,其中一种为两个相同的-COOH上的H,再结合其相对分子质量可得另一个为CH2CH2上H,故琥珀酸的结构简式为CH2CH2HOOCCOOH。
[答案] (1)①硫氰化钾溶液
②1 5 8 1 5 4 ③不可以
n(Fe2+)=0.01 mol/L×12.00×10-3 L×5×(1 000.00 mL/20.00 mL)=0.03 mol
m(Fe2+)=0.03 mol×56 g/mol=1.68 g
(10 g×20.00%-1.68 g)/(10 g×20.00%)=16.00%>10.00%,所以不可以服用
(2)CH2HOOCCH2COOH+2NaOH―→
NaOOCCH2CH2COONa+2H2O FeC4H4O4
13.(2008年上海化学)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。




 +
+
―→ + +
+
+
―→ + +
(2)反应中,被还原的元素是________,还原剂是________。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂、Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为________。
[解析] Au2O3转化为Au2O时,Au元素的化合价降低,说明在反应中Au2O3是氧化剂,在Na2S4O6中硫元素的平均化合价为+2.5价,Na2S2O3中硫元素的平均化合价为+2价,所以Na2S2O3应是还原剂,Na2S4O6是氧化产物。在(4)中1 mol Na2S2O3转化为H2SO4时失去8 mol e-,而1 mol Cl2转化为Cl-时得到2 mol e-,所以还原剂与氧化剂物质的量之比为1∶4。
[答案] (1)Na2S2O3 H2O Na2S4O6 Au2O NaOH

(2) Na2S2O3 (3) (4)1∶4
12.某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中,H2O2只发生如下过程:H2O2―→O2。
(1)该反应的还原剂是____________。
(2)若反应转移了0.3 mol电子,则产生的气体在标准状况下的体积是______L。
(3)写出该反应的化学方程式:______________________。
[解析] (1)H2O2发生的过程:H2O2―→O2中O元素化合价升高,因此H2O2作还原剂。(2)反应中H2O2只作还原剂,当有1 mol O2生成时,转移电子2 mol,所以有0.3 mol电子发生转移时会产生0.15 mol O2,即标准状况下的体积为3.36 L。
(3)从化合价来判断,该反应的氧化剂为H2CrO4,发生的过程为:H2CrO4―→Cr(OH)3,根据得失电子守恒以及质量守恒知,该反应的化学方程式为:2H2CrO4+3H2O2===2Cr(OH)3↓+3O2↑+2H2O。
[答案] (1)H2O2
(2)3.36
(3)2H2CrO4+3H2O2===2Cr(OH)3↓+3O2↑+2H2O
11.(2008年山东理综)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O28Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O+2I-===2SO+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。______________、________________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是____________________________________________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为__________________________________________________________。
证明炉渣中含有FeO的实验现象为______________________________________
________________________________________________________________________。
[解析] (1)在CuFeS2中Cu的化合价为+2,S的化合价为-2,反应中化合价降低的元素是Cu、O,发生还原反应。
(2)SO2的吸收(c)和SO2的利用(b)。
(3)根据催化剂的特点分析。Fe3+有氧化性,能氧化I-,Fe2+具有还原性可被S2O氧化。
(4)Al3+能与过量的NaOH反应,生成可溶性的NaAlO2[或NaAl(OH)4]。Fe2+具有还原性,能被KMnO4氧化,从而被KMnO4溶液褪色。
[答案] (1)Cu、O (2)bc
(3)2Fe3++2I-===2Fe2++I2
S2O+2Fe2+===2SO+2Fe3+(离子方程式不配平也可)
(4)a.Al3++4OH-===AlO+2H2O[或Al3++4OH-===Al(OH)] b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
10.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液
③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.③④
C.①② D.①③④
[解析] ①浓硝酸还原产物为NO2,稀硝酸还原产物为NO。③浓硫酸是H2SO4分子中表现强氧化性,产物为SO2。稀硫酸是H+表现弱氧化性,产物为H2。
[答案] A
9.等物质的量的下列化合物在相应条件下完全分解后得到氧气最多的是 ( )
A.KClO3(加MnO2催化剂,加热)
B.KMnO4(加热)
C.H2O2(水溶液,加MnO2催化剂)
D.HgO(加热)
[解析] 由化学方程式:2KClO3MnO2△2KCl+3O2↑,2KMnO4K2MnO4+MnO2+O2↑,2H2O22H2O+O2↑,2HgO2Hg+O2↑可以看出,假设均有2 mol物质参与反应,KClO3产生的O2最多。
[答案] A
8.将足量的铜屑加入到100 mL浓度均为2 mol·L-1的HNO3和H2SO4的混合溶液中,充分反应后,转移电子的物质的量为 ( )
A.0.6 mol B.0.8 mol
C.0.45 mol D.0.4 mol
[解析] 从离子反应的角度来分析:
3Cu + 8H++2NO===3Cu2++2NO↑+4H2O 转移电子
3 mol 8 mol 2 mol 6 mol
足量 0.6 mol 0.2 mol x
由以上计算关系看,H+不足,按H+的量来计算:x= mol=0.45 mol。
[答案] C
7.若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是( )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
[解析] 所加氧化剂的氧化性要大于I2,但又不能大于Fe3+,故选C。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com