
题目列表(包括答案和解析)
8.氯原子对O3的分解有催化作用:O3+Cl===ClO+O2 ΔH1,ClO+O===Cl+O2 ΔH2,大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中正确的是
( )
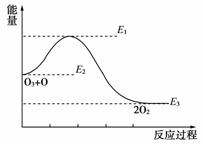
A.反应O3+O===2O2的ΔH=E1-E3
B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应
D.ΔH=ΔH1+ΔH2
[解析] O3+O的总能量高于2O2的能量,反应O3+O===2O2为放热反应,ΔH<0,ΔH=E3-E2,故A错,B错,C错;根据盖斯定律可得ΔH=ΔH1+ΔH2,D对。
[答案] D
7.已知:
①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量
下列叙述正确的是 ( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是
H2(g)+Cl2(g)===2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的
ΔH=+183 kJ·mol-1
C.氢气和氯气反应生成2 mol氯化氢气体,反应的
ΔH=-183 kJ·mol-1
D.氢气和氯气反应生成1 mol氯化氢气体,反应的
ΔH=-183 kJ·mol-1
[解析] 本题主要考查化学反应中的能量变化情况。书写热化学反应方程式时除标明反应物与生成物的聚集状态外,还必须标明与化学计量数相对应的热量变化值,A不正确;由已知条件知生成2 mol HCl气体时反应物的总键能为:436 kJ+243 kJ=679 kJ,而2 mol HCl的键能为2×431 kJ=862 kJ,所以生成2 mol HCl反应过程中放出的热量为:ΔH=679 kJ·mol-1-862 kJ·mol-1=-183 kJ·mol-1。
[答案] C
6.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
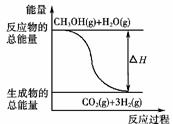 B.反应①中的能量变化如右图所示
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
[解析] A项,燃烧热指在101 kPa时,1 mol物质完全燃烧,生成稳定氧化物时放出的热量。B项,反应①是吸热反应,而图中所示是放热反应。C项,由题意知,也可以放热。D项,由燃烧热的定义和反应②可推知。
[答案] D
5.(2008年重庆理综)化学反应N2(g)+3H2(g)===2NH3(g)的能量变化如下图所示,该反应的热化学方程式是 ( )
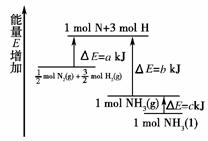
A.N2(g)+3H2(g)===2NH3(l);
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g);
ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)===NH3(l);
ΔH=2(b+c-a)kJ·mol-1
D.N2(g)+H2(g)===NH3(g);
ΔH=(a+b)kJ·mol-1
[解析] 本题考查热化学方程式的书写。由能量图象知,mol N2(g)和 mol H2(g)需要吸收a kJ的热量分解为1 mol N和3 mol H,而1 mol N和3 mol H放出b kJ的热量生成1 mol NH3(g),1 mol NH3(g)液化放出c kJ热量,因此由 mol N2(g)和 mol H2(g)生成1 mol NH3(l)的反应热为(a-b-c)kJ。故选A。
[答案] A
4.(2008年海南化学)白磷与氧可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P P c kJ·mol-1 c kJ·mol-1、OOd kJ·mol-1d kJ·mol-1。

根据上图的分子结构和有关数据估算该反应的ΔH,其中正确的是 ( )
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
[解析] 化学键断裂吸收的能量为(6a+5d)kJ,化学键生成放出的能量为(12b+4c)kJ。
[答案] A
3.(2008年上海化学)已知:H2(g)+F2(g)―→2HF(g)+270 kJ,下列说法正确的是 ( )
A.2 L氟化氢气体分解成1 L氢气与1 L氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量
D.1 个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ热量
[解析] A项中热化学方程式的化学计量数只表示物质的量;B项中气态HF变成液态HF要放出热量,故应大于270 kJ;C项中由高能量的反应物生成低能量的生成物才放出热量;D项中1 mol H2和1 mol F2反应生成2 mol HF放出的热量才是270 kJ。
[答案] C
2.(2008年北京理综)工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是 ( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
[解析] 本题借助工业上制备硅的反应来考查化学平衡、化学平衡的计算、反应热的知识点。该反应正反应为体积增大的反应,增大压强平衡左移,SiCl4转化率减小,A错;该反应为可逆反应,不能实现完全转化,平衡时吸收的热量一定小于Q kJ,B错;反应至4 min时,HCl的浓度为0.12 mol/L,表示的反应速率为:v(HCl)=0.03 mol/(L·min),换算为v(H2)=0.015 mol/(L·min),C错;当反应吸收0.025Q kJ热量时,说明参加反应的SiCl4为0.025 mol,生成的HCl为0.1 mol,其与100 mL 1 mol/L的NaOH恰好反应,D正确。
[答案] D
1.(2008年广东)下列有关能量转换的说法正确的是 ( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
[解析] 本题考查了自然界中能量的转化方式。动物体内葡萄糖的氧化是化学能转化为其他形式的能量,C错;光合作用是太阳能转化为化学能的过程,D错。
[答案] AB
14.某无色溶液,其中有可能存在的离子如下:Ag+、Na+、Ba2+、Al3+、AlO、S2-、CO、SO、SO。现取该溶液进行有关实验,实验结果如图所示:
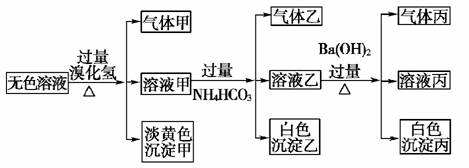
请回答下列问题:
(1)沉淀甲是____________,生成沉淀甲的离子方程式为
________________________________________________________________________。
(2)沉淀乙是______________,由溶液甲生成沉淀乙的离子方程式为________________________________________________________________________。
(3)沉淀丙是________________________,如何用一化学实验来确定其成分?________________________________________________________________________。
(4)气体甲的成分有哪几种可能?__________________________________________。
(5)综合上述信息,可以肯定存在的离子有_________________________________。
[解析] 首先分析4种阳离子与5种阴离子的共存关系,因为Ag+与所有的5种阴离子不可大量共存,立即排除Ag+,从而将沉淀甲锁定为S(即排除AgBr)。S沉淀生成的条件需要SO在酸性条件下与S2-反应,进一步可推得Ba2+不存在,再得沉淀乙只能是Al元素引起的沉淀Al(OH)3,对沉淀丙的分析:可由溶液乙的成分出发,乙溶液中的阴离子有过量余下的HCO及可能原溶液中SO,故丙沉淀为BaCO3或BaCO3、BaSO4两者的混合物。对Na+的判断可从溶液电中性的角度思考。然后利用题给反应信息再结合离子共存关系,则能顺利解答。
[答案] (1)S 2S2-+SO+6H+===3S↓+3H2O
(2)Al(OH)3 Al3++3HCO===Al(OH)3↓+3CO2↑
(3)BaCO3或BaCO3、BaSO4两者的混合物 在所得沉淀中加入足量稀盐酸,若沉淀不能全部溶解说明其中有BaSO4,如全溶解则为BaCO3
(4)①CO2 ②H2S ③SO2 ④H2S和CO2 ⑤SO2和CO2
(5)S2-、SO、AlO和Na+
13.(2007年全国Ⅰ理综)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO SO HSO |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是:
A______;B________;C________;D________;E________。
[解析] 解决本题的突破口在于④即B中加适量D有白色沉淀生成,加过量D沉淀量减少,所以B中含Al3+,D中含OH-,但加过量D时沉淀并不消失,D不能为NaOH,只能为Ba(OH)2,从而推断出B为Al2(SO4)3。结合①、②、③,A可和三种物质生成沉淀,推断A只能为Na2CO3。①、②中的沉淀均可溶于E溶液,E中的阴离子应为HSO,结合生成的白色沉淀能溶于E,阳离子可能为Na+或Mg2+,所以E为NaHSO4或Mg(HSO4)2。熟记溶解性表是解决本题的关键,也是解决离子共存问题、书写离子方程式等问题的必备知识。
[答案] Na2CO3 Al2(SO4)3 MgCl2 Ba(OH)2
NaHSO4[Mg(HSO4)2]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com