
题目列表(包括答案和解析)
5.将一小块钠投入盛饱和澄清石灰水的小烧杯里,不可能发生的是 ( )
A.钠熔成小球并在液面上游动
B.c(Ca2+)保持不变
C.烧杯中分散系由溶液变悬浊液
D.溶液的pH增大
[解析] 钠投入水中,与水剧烈反应生成氢氧化钠和氢气。钠的密度比水小,浮在液面上;溶液的碱性增强,pH增大;由于平衡Ca(OH)2(s)  Ca2+(aq)+2OH-(aq)向左移动,导致c(Ca2+)减小,溶液变浑浊。故符合题意的为B。
Ca2+(aq)+2OH-(aq)向左移动,导致c(Ca2+)减小,溶液变浑浊。故符合题意的为B。
[答案] B
4.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol·L-1的HCl溶液中和,则该生成物的成分是 ( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
[解析] 采用元素守恒法,n(HCl)=0.08 L×0.50 mol·L-1=0.04 mol,n(Na+)=n(Cl-)=0.04 mol,所以n(O)==mol,==,即1<<2,应为Na2O和Na2O2的混合物。
[答案] C
3.(2008年全国Ⅰ理综)在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH、Ba2+、Cl-、NO B.K+、AlO、Cl-、SO
C.Ca2+、Mg2+、NO、HCO D.Na+、Cl-、CO、SO
[解析] 溶液中加入Na2O2后,使溶液呈碱性,且Na2O2本身有氧化性。A项,NH与OH-反应而不能大量共存;C项,HCO与OH-反应生成正盐而不能大量共存;D项Na2O2与SO因发生氧化还原反应而不能大量共存。
[答案] B
2.(2009年北京理综)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图所示的转化关系(部分生成物和反应条件略去)。
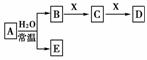
下列推断不正确的是 ( )
A.若X是Na2CO3,C为含极性键的非极性分子, 则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是OH-+HCO===H2O+CO,则E一定能还原Fe2O3
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是Na+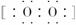 2-Na+
2-Na+
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
[解析] A项,当A为NO2时,3NO2+H2O===2HNO3+NO,HNO3与Na2CO3反应产生CO2,CO2+Na2CO3+H2O===2NaHCO3,也符合框图;B项,由B和D的反应可知,B为强碱,则A为Na等非常活泼的金属,E为H2,X为CO2等酸性气体;C项,此时B为O2,X为C,C为CO2,CO2可与E(NaOH)反应;D项,短周期元素形成白色沉淀有Mg(OH)2、Al(OH)3,且A与D的摩尔质量相等,则由Al(OH)3的摩尔质量为78 g/mol,推知A为Na2O2,B为NaOH,X为铝盐:4OH-+Al3+===AlO+2H2O,Al3++3AlO+6H2O=== 4Al(OH)3↓。
[答案] A
1.(2009年全国Ⅰ理综)为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是 ( )
A. B.
C. D.
[解析] 设样品中含NaHCO3 x g,
2NaHCO3Na2CO3+CO2↑+H2O Δm
2×84 106 62
x w1-w2
x= (g),
则Na2CO3的质量分数为:=。
[答案] A
13.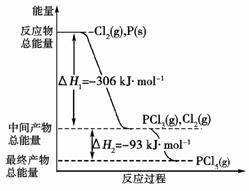 (2008年全国Ⅱ理综)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如右图所示(图中的ΔH表示生成1
mol产物的数据)。
(2008年全国Ⅱ理综)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如右图所示(图中的ΔH表示生成1
mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是___________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是____________________________;上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是__________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________________。
[解析] 本题重点考查化学反应中的能量变化及化学平衡理论。(1)、(2)中ΔH=生成物的总能量-反应物的总能量,不难写出两个热化学方程式。分解率α1=×100%=25%;升温,化学平衡向吸热反应方向移动,因PCl5的分解要吸热,故升温,分解率增大,α2>α1。
(3)降温,化学平衡向放热反应方向移动。
(4)根据盖斯定律:一个化学反应不论是一步完成还是多步完成,其热效应总是相同的。
(5)PCl5和水的反应为水解反应。
[答案] (1)Cl2(g)+P(s)===PCl3(g);ΔH=-306 kJ·mol-1
(2)PCl5(g)===PCl3(g)+Cl2(g);ΔH=93 kJ·mol-1 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ·mol-1 等于
(5)PCl5+4H2O===H3PO4+5HCl
12.(2008年江苏苏北模拟)应用纳米技术制备的纳米金属燃料已应用到社会生活和高科技领域。一些原子序数较小的金属、非金属和常用燃料的单位质量燃烧热的比较如下图所示[肼(N2H4)和硼烷(B5H9)为传统火箭燃料]。
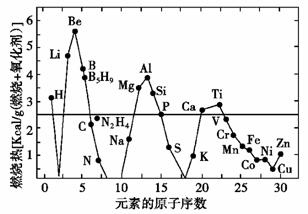
请回答下列问题:
(1)结合元素在地壳中的含量,在单位质量燃烧热大于汽油和氢单质的物质中,最具发展潜力的两种。
新型燃料可以是________(填写元素符号)。这些物质作为燃料使用,除具有高燃烧热值外,还具有的优点是________________________________________(填一项)。
(2)使金属在较低温度下燃烧的关键技术之一是将其制成纳米、微米级的颗粒。如此,不仅降低了金属燃料的燃点,也使得燃烧更为容易和充分,其原因是________________________________________________________________________
________________________________________________________________________。
(3)Be粉和MnO2粉末在高温下可以反应(类似铝热反应),请写出反应的化学方程式________________________________;根据图示推测可能的原因是________________________________________________________________________
________________________________________________________________________。
[解析] 本题考查的是图象的理解。难度一般。(1)从题意可知,应该从元素在地壳中的含量考虑,所以最具潜力的新型燃料应该是在地壳中含量较高的元素,即Al、Si。这些物质作为燃料时,由于其含量较多,所以优点为原料充足,而且由于其燃烧的产物在自然界中大量存在,所以还可再生且燃烧产物几乎无污染。
[答案] (1)Al、Si 原料充足且可再生或燃烧产物几乎无污染
(2)块状金属一旦“制成纳米、微米级的颗粒”,便极大地增加了与空气(氧气)的接触面积。加大了化学反应的速率
(3)2Be+MnO2Mn+2BeO Be有较高的单位质量燃烧热,比Al的还要大
11.(2009年江苏单科)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_____(填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g);ΔH=+64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g);ΔH=-196.46 kJ·mol-1
H2(g)+O2(g)===H2O(l);ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为________________________________________________________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40 ℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是____________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是________________________________________________
________________________________________________________________________。
[解析] (1)B会引起大气污染;D会造成土壤、水体重金属污染。
(2)总方程式为Cu+H2O2+2H+===Cu2++2H2O,它可由题目提供的3个方程式得到,故ΔH=64.39+(-196.46)×+(-285.84)=-319.68 kJ·mol-1
故Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);
ΔH=-319.68 kJ·mol-1。
[答案] (1)BD (2)Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);ΔH=-319.68 kJ·mol-1
(3)H2O2分解速率加快
(4)2Cu2++SO+2Cl-+H2O2CuCl↓+SO+2H+
10.已知:
CH3CH2CH2CH3(g)+6.5O2(g)―→4CO2(g)+5H2O(l)+2 878 kJ
(CH3)2CHCH3(g)+6.5O2(g)―→4CO2(g)+5H2O(l)+2 869 kJ
下列说法正确的是 ( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
[解析] 本题是考查物质稳定性及能量变化的题目,1 mol正丁烷燃烧放出2 878 kJ热量,1 mol异丁烷燃烧放出2 869 kJ热量,正丁烷燃烧放出热量大于异丁烷燃烧放出热量,故A正确;正丁烷能量大,稳定性差,故B错误;两式相减得CH3CH2CH2CH3(g)―→(CH3)2CHCH3(g)+9 kJ,异丁烷转化为正丁烷是一个吸热过程。正丁烷和异丁烷是同分异构体,具有相同C-H键,都含有10个C-H键。
[答案] A
9.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)===SnCl2(aq)+H2(g);ΔH1
②Sn(s,灰)+2HCl(aq)===SnCl2(aq)+H2(g);ΔH2
③Sn(s,灰)>13.2 °C<13.2 °CSn(s,白);ΔH3=+2.1 kJ·mol-1
下列说法正确的是 ( )
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2 °C的环境中,会自行毁坏
[解析] 根据盖斯定律,②-①,得Sn(s,灰)Sn(s,白);ΔH3=ΔH2-ΔH1=+2.1 kJ·mol-1,因此很容易判断出,A、B、C是错误的;由③可看出,在低于13.2 °C的环境,白锡易变成粉末状的灰锡,自行毁灭。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com