
题目列表(包括答案和解析)
4.下列判断(或叙述)中,正确的是 ( )
A.原子半径:Na>Mg>O>H
B.玻璃的熔点高于NaCl的熔点
C.将1 mol FeCl3全部制成Fe(OH)3胶体,其中含有Fe(OH)3胶体粒子数为NA个(NA表示阿伏加德罗常数)
D.1 mol O2与金属钠完全反应,转移的电子数为4NA
[解析] 玻璃是一种混合物,没有固定的熔点;胶体粒子是多个分子的聚集体;O2与钠反应如果生成Na2O2,则转移2NA个电子。故B、C、D项错误。
[答案] A
3.取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是 ( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质
A.②⑤ B.①②③
C.①④⑤ D.④⑤
[解析] 金属钠熔点低,放在燃烧匙里加热,先熔化为小球,在空气中燃烧,火焰呈黄色,燃烧后生成浅黄色的Na2O2。
[答案] C
2.如下图向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入绿豆大小的金属钠,可能观察到的现象是 ( )
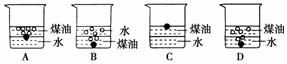
[解析] 钠的密度比水小,比煤油大,故钠浮在水面上,沉在煤油底。
[答案] A
1.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是 ( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
[解析] Na2O→NaOH,NaOH→Na2CO3这两个反应不是氧化还原反应。
[答案] D
14.钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为________。
(2)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2===2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L(标准状况),计算反应消耗的KO2的质量。
[解析] (1)样品中氧全部来自K2O2,设样品中K2O2的质量分数为x,样品的质量为m g,则=0.28。
x=0.962 5,即96.25%。
(2)4KO2+2CO2===2K2CO3+3O2 Δn(气体)
4 mol 1 mol
n(KO2) =0.25 mol
n(KO2)=1 mol m(KO2)=1 mol×71 g·mol-1=71 g。
[答案] (1)96.25% (2)71 g
58.5 36.5
m(NaCl) 1 000 t×36.5%
m(NaCl)==585 t
(4)②为碱吸收酸性氧化物,充分吸收后生成NaHSO3。④为强酸与弱酸的酸式盐反应回收SO2。
(5)“吊白块”的结构中含有醇羟基,所以能与Na反应,能被氧化成醛基。
[答案] (1)ⅠA (2)物理变化 (3)NaCl 585
(4)②NaOH+SO2===NaHSO3
④NaHSO3+HCl===NaCl+H2O+SO2↑ (5)CD
13.海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是____________(填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是____________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐__________t。
(可能需要的相对原子质量:Na:23 Cl:35.5 H:1 O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:___________________________________________
________________________________________________________________________。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有________。(填字母)
A.皂化反应 B.聚合反应
C.与金属钠反应 D.氧化反应
[解析] (1)NaCl中的金属元素为Na,Na属于ⅠA族元素。
(2)由海水转化为淡水,水的分子组成没有发生变化,属于物理变化。
(3)据2NaCl+2H2O2NaOH+H2↑+Cl2↑
H2+Cl2===2HCl
可知 NaCl - HCl
12.(2009年四川理综)已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2∶3,且能与水反应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
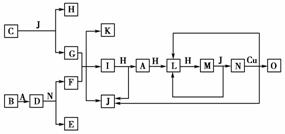
请回答下列问题:
(1)组成B单质的元素位于周期表第________周期,第______族。化合物C的电子式为________________________________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
________________________________________________________________________。
(4)写出D与足量的N反应生成E和F的化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有________个。
[解析] 根据题意可判断出B为Mg,D为Mg3N2,则A只能为N2;又因C为淡黄色固体化合物,则为Na2O2(或K2O2);又因O和G生成蓝色沉淀,则G为NaOH,H为O2,从而可得I(NH3)A(N2)L(NO)M(NO2)N(HNO3)O[Cu(NO3)2],其他物质略。(5)符合条件的有Na2O2(或K2O2)与水的反应、NO2和水的反应。
[答案] (1)三 ⅡA
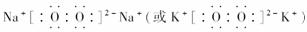
(2)水分子之间存在氢键
(3)4NH3+3O22N2+6H2O
(4)Mg3N2+8HNO3===3Mg(NO3)2+2NH4NO3 (5)2
11.某氯化钾样品中含少量杂质硫酸钾和碳酸钾,为了除去杂质,要做以下实验:

试根据上述实验方案回答:
(1)气体E是________,X________,Y________。
(2)固体A的成分________,固体C的成分________。(填化学式)
[解析] 要除去KCl中混有的少量杂质K2SO4、K2CO3,可先用过量BaCl2溶液除去SO和CO,然后用过量K2CO3溶液除去上述实验中引入的Ba2+,再用过量HCl除去引入的CO,最后对所得KCl溶液加热蒸干即得纯净KCl晶体。
[答案] (1)CO2 BaCl2 K2CO3
(2)BaSO4和BaCO3 BaCO3
10.可能存在的第119号未知元素,有人称为“类钫”,根据周期表结构及元素性质变化趋势,有关“类钫”的预测,说法不正确的是 ( )
A.“类钫”在化合物中是+1价
B.“类钫”具有放射性
C.“类钫”单质的密度大于1 g·cm-3
D.“类钫”单质有较高的熔点
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com