
题目列表(包括答案和解析)
14.向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是 ( )

|
|
a |
b |
c |
d |
|
A |
Cl- |
K+ |
CO |
HCO |
|
B |
K+ |
CO |
Cl- |
HCO |
|
C |
K+ |
CO |
HCO |
Cl- |
|
D |
K+ |
HCO |
Cl- |
CO |
[解析] 向K2CO3溶液中缓慢滴加稀盐酸时,n(K+)不变,n(CO)减少,n(HCO)先增加后减少,且当n(CO)=0时n(HCO)最大,n(Cl-)增大,结合曲线图分析C项符合题意。
[答案] C
13.向溶有0.01 mol KOH和0.01 mol Ba(OH)2的水溶液中通入CO2气体,下列图象能正确反映通入CO2气体的体积和沉淀物质的量的关系的是(横坐标表示通入CO2气体的体积,纵坐标表示沉淀的物质的量) ( )

[解析] 向KOH和Ba(OH)2混合液中通入CO2发生反应顺序是:
①Ba(OH)2+CO2===BaCO3↓+H2O
②2KOH+CO2===K2CO3+H2O
③K2CO3+CO2+H2O===2KHCO3
④BaCO3+CO2+H2O===Ba(HCO3)2。
[答案] C
12.用1 L 1.0 mol·L-1 NaOH溶液吸收0.8 mol CO2,所得溶液中的CO和HCO的物质的量浓度之比约是 ( )
A.1∶3 B.1∶2
C.2∶3 D.3∶2
[解析] 设反应按NaOH+CO2===NaHCO3进行,由题意可知过剩的NaOH为1.0 mol-0.8 mol=0.2 mol,过剩的NaOH中和掉HCO得0.2 mol CO,HCO为0.8 mol-0.2 mol=0.6 mol,故n(CO)∶n(HCO)=1∶3。或先发生2NaOH+CO2===Na2CO3+H2O反应、1.0 mol NaOH吸收0.5 mol CO2生成0.5 mol Na2CO3,然后发生Na2CO3+CO2+H2O===2NaHCO3反应,余下0.3 mol CO2与0.3 mol Na2CO3反应生成0.6 mol NaHCO3,故n(CO)∶n(HCO3)=1∶3。
[答案] A
11.将一定质量的钠、钾分别投入到装有相同浓度和体积盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法中正确的是 ( )
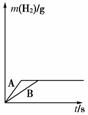
A.投入的Na、K的质量一定相等
B.投入的Na的质量小于K的质量
C.曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应
D.参加反应的HCl的量不一定相等
[解析] 本题以元素钾和钠为背景考查学生的识图能力,因二者产生的氢气的量相等,所以两种金属的物质的量相等。结合两金属的活动性知钾与盐酸反应的速率较钠与盐酸反应的速率快,所以曲线A表示钾与盐酸反应,曲线B表示Na与盐酸反应,又盐酸的体积和浓度相同,所以上述反应中消耗的盐酸的量相等。
[答案] B
10.在25 ℃ 101 kPa下,由HCHO(g)、H2和CO组成的混合气体共6.72 g,其相对氢气的密度为14。将该气体与2.24 L氧气(标准状况下)充分反应后的产物通过足量的Na2O2粉末,Na2O2粉末增重的质量 ( )
A.等于6.72 g B.小于6.72 g
C.大于6.72 g D.无法计算
[解析] 混=14×2 g·mol-1=28 g·mol-1,
n混==0.24 mol,n(O2)==0.1 mol,2CO+O22CO2,2H2+O22H2O,HCHO+O2CO2+H2O,2CO2+2Na2O2===2Na2CO3+O2,2H2O+2Na2O2=== 4NaOH+O2↑,由上述方程式可知,CO、H2、HCHO完全燃烧时将全部被Na2O2吸收,但0.24 mol混合气体完全燃烧消耗的O2要大于0.12 mol,说明混合气体没有完全燃烧,将不能完全与Na2O2反应而被Na2O2全部吸收。故选B。
[答案] B
9.在一定条件下,使H2和O2的混合气体26 g充分反应,所得混合物在适当温度下跟足量的Na2O2固体反应,结果固体增重2 g,则原混合气体中O2和H2的质量比可能是
( )
A.1∶12 B.5∶8
C.3∶10 D.12∶1
[解析] 根据反应2Na2O2+2H2O===4NaOH+O2↑,用差量法得出m(H2O)=18 g;由反应2H2+O2===2H2O算出参加反应的m(H2)=2 g,m(O2)=16 g,而实际混合气体有26 g,故有8 g H2或8 g O2过量。所以,O2和H2的质量比为8∶5或12∶1,故选D。
[答案] D
8.我国首位航天员杨利伟乘坐的“神舟”五号载人飞船,发射升空后,按照预定计划,绕地球飞行14圈后成功返回。标志着我国成为继苏、美两大国后的第三个进入太空的国家。为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或者KO2颗粒的装置,它的用途是再生氧气。用Na2O2和KO2分别与CO2反应,产生等量的氧气,所需Na2O2和KO2的质量之比约为 ( )
A.5∶3 B.3∶5
C.2∶1 D.3∶1
[解析] 根据2Na2O2+2CO2===2Na2CO3+O2和4KO2+2CO2===2K2CO3+3O2。若生成3 mol O2,需Na2O2为6 mol,需KO2为4 mol。m(Na2O2)∶m(KO2)=6 mol×78 g·mol-1∶4 mol×71 g·mol-1≈5∶3。
[答案] A
7.向CuSO4、AlCl3、Fe(NO3)2的混合溶液中投入一小块金属钠,首先被置换出的是
( )
A.Fe B.Cu
C.Al D.H2
[解析] 活泼的金属如钠与水溶液的反应,有句这样的口诀要记住:遇酸酸优先,无酸水在前。盐溶液中:第一步,先考虑钠与水的反应:2Na+2H2O===2Na++2OH-+H2↑,第二步,再考虑生成的NaOH能否与盐反应。
[答案] D
6.等物质的量的下列物质分别与足量的NaOH溶液完全反应,需要NaOH的量最多的是 ( )
A.NaHSO4
B.AlCl3
C.SiO2

[解析] 根据反应:NaHSO4+NaOH===Na2SO4+H2O,
AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,
SiO2+2NaOH===Na2SiO3+H2O,

[答案] B
5.在一定温度下,向饱和的氢氧化钠溶液中加入一定量的过氧化钠,充分反应后,恢复到原来温度,下列说法正确的是 ( )
A.溶液中Na+浓度增大,有O2放出
B.溶液pH不变,有O2放出
C.溶液中Na+数目减少,有H2放出
D.溶液中Na+数目不变,有O2放出
[解析] 过氧化钠与水反应会产生氧气;原饱和溶液中水被消耗,溶液中氢氧化钠部分析出,故溶液中Na+的数目减少,但析出晶体后的溶液仍为饱和溶液,氢氧化钠的浓度不变,溶液的pH不变。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com