
题目列表(包括答案和解析)
3.(2008年江苏化学)研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果。下列表达不正确的是 ( )
A.密闭容器中CuO和C高温反应的气体产物:
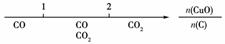
B.Fe在Cl2中的燃烧产物:

C.AlCl3溶液中滴加NaOH后铝的存在形式:
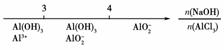
D.氨水与SO2反应后溶液中的铵盐:

[解析] A项反应为CuO+CCu+CO↑,2CuO+C2Cu+CO2↑;B项中不论Fe过量与否都不生成FeCl2;C项反应为3OH-+Al3+===Al(OH)3↓,4OH-+Al3+===AlO+2H2O;D项反应为NH3·H2O+SO2===NH4HSO3,2NH3·H2O+SO2===(NH4)2SO3+H2O。
[答案] B
2.(2008年广东化学)设阿伏加德罗常数的数值为nA,下列说法正确的是 ( )
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
[解析] A项,1 mol Cl2与足量Fe反应,转移电子数应为2nA;D项根据方程式3Fe+4H2O(g)Fe3O4+4H2,0.1 mol Fe粉完全反应生成H2的分子数为nA。
[答案] BC
1.(2008年四川非延考区)下列说法中不正确的是 ( )
A.1 mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 L
B.1 mol臭氧和1.5 mol氧气含有相同的氧原子数
C.等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3
[解析] C项,磷酸为弱电解质,不能完全电离,而盐酸为强酸,可完全电离,所以两者电离出的氢离子浓度之比应小于3∶1。
[答案] C
21.(10分)取等物质的量浓度的NaOH溶液两份,每份为50 mL。向其中各通入一定量的CO2,随后分别各取溶液10 mL,将其稀释成100 mL,并分别向稀释后的溶液中逐滴加入0.1 mol·L-1的HCl溶液,产生CO2的气体体积(标准状况)与所加盐酸的体积之间的关系如下图所示(设分别为A、B两种情况)
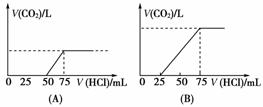
回答下列问题:
(1)在(A)情况下,溶质为(写化学式)________________,其物质的量之比为________,在标准状况下,通入CO2气体的体积为________。
(2)在(B)情况下,溶质为(写化学式)__________________,其物质的量之比为______,在标准状况下,通入CO2气体的体积为______。
(3)原NaOH溶液的物质的量浓度为____________。
[答案] (1)NaOH,Na2CO3 1∶1 280 mL
(2)Na2CO3,NaHCO3 1∶1 560 mL
(3)0.75 mol·L-1
20.(12分)某学生拟用50 mL NaOH溶液吸收CO2气体制备Na2CO3溶液。为了防止通入CO2气体过量而生成NaHCO3,他设计了如下实验:①取25 mL NaOH溶液吸收过量的CO2气体,至CO2不再溶解;②小心煮沸1-2分钟,排出溶解的CO2气体;③在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)他能否得到纯净的Na2CO3?________(能或不能),理由是________________________________________________________________________
________________________________________________________________________。
(2)按他的设计,第①步实验装置如下图所示:
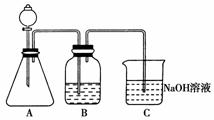
①装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?________,原因是__________________________________________________________。
②装置B使用的试剂是________,作用是______________________________________________________________。
③为了便于后继实验的煮沸、混合等操作,盛装NaOH溶液的容器还可以使用________(填仪器名称)。
④有人认为实验步骤②、③的顺序对调,即先混合再煮沸更合理,你认为对吗?________,为什么?__________________________________________________________。
[答案] (1)能 实验①生成NaHCO3溶液,其中溶解的CO2在实验②煮沸时除去,在实验③中NaHCO3恰好被NaOH中和,完全生成Na2CO3
(2)①不能 不能用粉状固体,反应速率过快,不易控制
②水 除去CO2中的HCl气体 ③锥形瓶
④不对 由于NaHCO3溶液中溶有CO2气体,加入NaOH必首先和CO2反应,不能把NaHCO3全部转化为Na2CO3
19.(10分)甲、乙、丙是前18号元素形成的常见单质,A、B、C、D是前18号元素形成的不同化合物,甲、乙、丙和A、B、C、D有如下图所示的转化关系,丙是生命活动中不可缺少的气态单质,请回答下列问题:
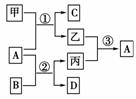
(1)若甲为金属单质,则A的化学式为____________,写出反应①的化学方程式:________________________,标出反应②中电子转移的方向和数目:________________________________________________________________________。
(2)若甲为非金属单质,则A的电子式为________,C的化学式为________,指出B的一种用途__________,写出反应②的离子方程式:________________________________________________________________________。
[解析] 根据丙是生命活动中不可缺少的气态单质,可知丙为O2,则A为氧化物,能与氧化物反应生成O2的化合物B为Na2O2,则A只能是H2O或CO2。当甲为非金属单质时,符合图示关系的A只能为H2O;则当甲为金属单质时,符合图示关系的A应为CO2。(1)能与CO2反应生成单质及化合物的金属单质为Mg。(2)能与H2O反应生成单质及化合物的非金属单质为C,反应的产物为CO和H2。Na2O2通常用做供氧剂、漂白剂及氧化剂。
[答案] (1)CO2 2Mg+CO22MgO+C
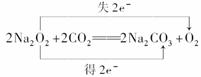
(2)H  H CO 供氧剂、漂白剂、氧化剂(任答一种)
H CO 供氧剂、漂白剂、氧化剂(任答一种)
2Na2O2+2H2O=== 4Na++4OH-+O2↑
18.(10分)有A、B、C三种粉末,其焰色反应均为紫色,它们具有下列性质:
①均易溶于水,且A与B反应生成C;
②加热B的粉末时,生成无色无刺激性气味的气体D,D能使澄清的石灰水变浑浊,浑浊物为E;
③加热A、C时均不反应;
④向少量C溶液中通入D可以得到B;
⑤A溶液和D反应,D过量时生成B,D不足时生成C。
请回答下列问题:
(1)写出下列物质的化学式:A________、B__________、
C________、D________、E________。
(2)用离子方程式表示下列反应:
A+_____________________________________________________________________;
D→E____________________________________________________________________;
C+_____________________________________________________________________;
A+_____________________________________________________________________;
A+_____________________________________________________________________。
[答案] (1)KOH KHCO3 K2CO3 CO2 CaCO3
(2)HCO+OH-===CO+H2O
CO2+Ca2++2OH-===CaCO3↓+H2O
CO+CO2+H2O===2HCO
CO2+OH-===HCO
CO2+2OH-===CO+H2O
17.(10分)某校学生课外活动小组为测定Na元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为a g,从实验室取出b g(不足量)的钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为c g,试回答:

(1)实验室取用一小块钠,需要的用品有
________________________________________________________________________。
(2)此干燥管的作用是:___________________________________________________
________________________________________________________________________,
若不用此干燥管,则测出的相对原子质量会比实际相对原子质量________(填“偏大”“偏小”或“不变”,下同),若此钠块中有极少量被氧化,则会________________________________________________________________________。
(3)有甲同学建议在图中干燥管上再连一同样干燥管(设此干燥管质量为m g),其目的是:________________________________________________________________________
________________________________________________________________________,
若所增加干燥管待完全反应后质量变为m1 g,则依甲同学建议,计算钠的相对原子质量的表达式为_______________________________________________________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量的煤油,其目的是________________________________________________________________
________________________________________________________________________。
(5)若生成的NaOH溶液恰好使100 mL C mol·L-1硫酸铝溶液中Al3+沉淀完全,则C=________(以a、b、c的表达式表示)。
[解析] 2Na+2H2O===2NaOH+H2↑
2M 2
b g (a+b-c)g
M=,依此式进行误差分析。
[答案] (1)滤纸、小刀、镊子、玻璃片
(2)吸收水蒸气,避免集气瓶中水蒸气逸出 偏小 偏大
(3)避免空气中水蒸气被干燥剂吸收
(4)避免钠投入后,立即与水反应,来不及塞上塞子
(5)5(a+b-c)/3 mol·L-1
16.有编号为1、2、3、4的四瓶无色液体,仅知道是1%酚酞、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1盐酸和0.1 mol·L-1 NaCl溶液,现要求甲、乙、丙、丁四位学生进行鉴别,而且每人只鉴别两瓶溶液,告诉学生鉴别两瓶溶液都正确得满分,只有一瓶正确的可以及格。四位学生的鉴别结果如下:
|
甲 |
1号为0.1
mol·L-1盐酸 |
4号为0.1
mol·L-1 NaCl溶液 |
老师评价:四位学生都及格,但是没有一个得满分 |
|
乙 |
1号为0.1
mol·L-1 NaOH溶液 |
3号为0.1
mol·L-1盐酸 |
|
|
丙 |
1号为1%酚酞 |
2号为0.1
mol·L-1盐酸 |
|
|
丁 |
4号为0.1
mol·L-1盐酸 |
2号为0.1
mol·L-1 NaOH溶液 |
正确的结论是 ( )
A.1号为1%酚酞
B.2号为0.1 mol·L-1 NaCl溶液
C.3号为0.1 mol·L-1 NaOH溶液
D.4号为0.1 mol·L-1盐酸
[解析] 根据题意,每组都有一个是对的,在乙、丁中都分别为NaOH、HCl,对的NaOH、HCl在其中,甲、丙中的HCl不对,那么另一瓶就是对的,可确定1号为酚酞,4号为NaCl。那么乙中的1号为NaOH就不对,3号为HCl是对的,2号为NaOH,故最后应选A。
[答案] A
第Ⅱ卷 (非选择题,52分)
15.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
( )
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
工业生产硫酸用水吸收SO3 |
SO3可与水反应 |
Ⅰ对;Ⅱ对;有 |
|
B |
Cl2和SO2混合后可用于漂白纸浆 |
Cl2和SO2都有较好的漂白作用 |
Ⅰ对;Ⅱ错;无 |
|
C |
金属钠具有强还原性 |
高压钠灯发出透雾性强的黄光 |
Ⅰ对;Ⅱ对;有 |
|
D |
石墨常用做电解池的电极 |
石墨的化学性质稳定且导电性好 |
Ⅰ对;Ⅱ对;有 |
[解析] A项工业上用98.3%的浓硫酸吸收SO3而不用水。B项Cl2和SO2混合后与水反应SO2+Cl2+2H2O===2HCl+H2SO4,失去漂白性。C项Ⅰ和Ⅱ不是因果关系。D项石墨作电极就是利用其稳定性和导电性。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com