
题目列表(包括答案和解析)
3.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.5.6 g铁与足量盐酸反应转移的电子数为0.3NA
B.100 mL 2 mol·L-1的盐酸与醋酸溶液中氢离子数均为0.2NA
C.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
D.20 g重水(D2O)中含有的电子数为10NA
[解析] 5.6 g Fe与足量盐酸反应时失去0.2 mol电子;醋酸是弱电解质,在水溶液中只有很少一部分电离成离子;氟气是双原子分子,稀有气体是单原子分子。
[答案] D
2.下列说法正确的是 ( )
A.200 mL 1 mol·L-1Al2(SO4)3溶液中,Al3+和SO离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1 mol Br原子中含中子数为3.5×6.02×1023
D.30 g甲醛中含共用电子对总数为4×6.02×1023
[解析] A项中Al3+水解,使Al3+与SO离子总数小于6.02×1023。B项中分子总数为6.02×1023。C项中中子数为4.6×6.02×1023。D项中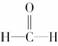 ,1个分子内含4个共价键,故D项正确。
,1个分子内含4个共价键,故D项正确。
[答案] D
1.用NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.0.5 mol Al与足量盐酸反应转移电子数为NA
B.标准状况下,11.2 L SO3所含的分子数为0.5NA
C.0.1 mol CH4所含的电子数为NA
D.46 g NO2和N2O4的混合物含有的分子数为NA
[解析] A项0.5 mol Al与盐酸反应生成Al3+失电子数为1.5NA。B项由于SO3在标准状况下呈固态。D项因N2O4的存在,46 g混合物含有的分子数一定小于NA。C项CH4为10电子分子,0.1 mol CH4中应含NA个电子。
[答案] C
14.矾是指含有结晶水的硫酸盐,如绿矾(FeSO4·7H2O)、明矾[KAl(SO4)2·12H2O]、皓矾(ZnSO4·10H2O)等。在用绿矾配制FeSO4溶液时,为防止FeSO4水解,应在其中加入少量稀硫酸,如果FeSO4溶液在空气中长时间放置,会有部分Fe2+氧化为Fe3+。为了测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+氧化的百分率,某同学准确量取pH=1(忽略Fe2+和Fe3+的水解)的FeSO4溶液200 mL,加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀的质量为28.0 g;另取同样的FeSO4溶液200 mL,向其中加入过量的NaOH溶液,搅拌使之充分反应,待沉淀全部转化为红褐色沉淀后,过滤、洗涤并灼烧所得固体使其完全分解,最终所得固体可以恰好被2.7 g Al 还原,试通过计算回答下列问题:
(1)原溶液中H+、SO的物质的量浓度分别是多少?
(2)原溶液中Fe2+氧化的百分率是多少?
[解析] (1)根据pH=1知,c(H+)=0.1 mol·L-1,
n(SO)=n(BaSO4)==0.12 mol,
c(SO)==0.6 mol·L-1。
(2)根据反应:2Al+Fe2O32Fe+Al2O3
n(Fe2O3)=n(Al)=×=0.05 mol。
根据Fe原子守恒知,原溶液中Fe2+和Fe3+的总物质的量为0.05 mol×2=0.1 mol。
设原溶液中Fe2+和Fe3+的物质的量分别为x、y
则x+y=0.1 mol①
根据电荷守恒得:2x+3y+0.1 mol·L-1×0.2 L=0.12 mol×2②
解①②组成的方程组得:x=0.08 mol y=0.02 mol。
原溶液中Fe2+氧化的百分率为×100%=20%。
[答案] (1)c(H+)=0.1 mol·L-1 c(SO)=0.6 mol·L-1 (2)20%
13.配制500 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为____________。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为________________________________________________________________________
________________________________________________________________________。
假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示)。
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
称量(取用砝码)过程 |
|
|
|
|
|
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1-2 cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2-3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序____________________。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是__________________。
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
[答案] (1)10 (2)高于 将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡 32.6 g
|
砝码质量/g |
50 |
20 |
20 |
10 |
5 |
|
取用砝码过程 |
↑↓ |
↓ |
↓↑ |
↓ |
↓↑ |
(3)①③④②⑤ (4)ACD
12.根据下列各题中所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量浓度”,试判断并求解。
(1)已知某氢氧化钠溶液V L中含有n个氢氧根离子,可求出此溶液的____________________是____________________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液的________________为________________。
(3)已知标准状况下氯化氢气体的溶解度为500,则可求出标准状况下氯化氢饱和溶液的________________为________________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得白色固体b g,则可求出原氯化铝溶液的________________为________________。
[解析] (1)已知NaOH溶液中OH-数目,即可求得NaOH的物质的量,又知道溶液的体积,可求出溶液的物质的量浓度:
c(NaOH)== mol·L-1。
(2)已知NaOH溶液中Na+与H2O的个数之比,即物质的量之比,可求得NaOH与H2O的质量比,进而求得溶液中溶质的质量分数:
w(NaOH)=×100%=×100%=×100%。
(3)已知气体的溶解度,但不知所得溶液的密度,只能求得溶液中溶质的质量分数,假定1 L H2O中溶解500 L HCl,则:
w(HCl)=
×100%=44.9%。
(4)AlCl3溶液加热蒸干灼烧得到的白色固体为Al2O3,据Al2O3的质量可求得AlCl3的物质的量,又知溶液的体积,可求得AlCl3溶液的物质的量浓度:
n(AlCl3)=2n(Al2O3)=2×= mol
c(AlCl3)== mol·L-1。
[答案] (1)物质的量浓度 mol·L-1
(2)溶质的质量分数 ×100%
(3)溶质的质量分数 44.9%
(4)物质的量浓度 mol·L-1
11.(2007年郑州)50 g物质的量浓度为c1的浓H2SO4质量分数w1,与V mL水混合,得到物质的量浓度为c2的稀H2SO4质量分数为w2(以下填“<”“>”或“=”)
(1)若w1=2w2,则c1________2c2,V________50 mL。
(2)若c1=2c2,则w1________2w2,V________50 mL。
[解析] 对硫酸溶液来说,加水稀释,密度变小,当溶液的质量为原溶液的2倍时,溶液的体积大于原来的2倍。当溶液的体积增大为原有溶液的2倍时,由于密度变小,溶液的质量增大不到原来的2倍。
[答案] (1)> = (2)< <
10.将3.20 g Cu跟30.0 mL 10.0 mol·L-1的硝酸反应,Cu全部溶解,产物只有NO和NO2。若反应后溶液中有a mol H+,则此时溶液中含有NO离子的物质的量为 ( )
A.a/2 mol B.2a mol
C.0.1a mol D.(a+0.1)mol
[解析] 反应后的溶液为Cu(NO3)2与HNO3的混合液,则n(NO)=n(H+)+2n(Cu2+)=a mol+2×0.05 mol=(a+0.1)mol。
[答案] D
5.6 g 1.8 g 7.4 g
由于水的消耗,1.8 g水溶解的Ca(OH)2要析出,使沉淀物的质量大于7.4 g,而饱和石灰水的质量小于98.2 g。
[答案] D
9.某温度下向100 g澄清的饱和石灰水中加入5.6 g生石灰,充分反应后恢复到原来的温度。下列叙述正确的是 ( )
A.沉淀物的质量为5.6 g
B.沉淀物的质量为7.4 g
C.饱和石灰水的质量大于98.2 g
D.饱和石灰水的质量小于98.2 g
[解析] CaO+H2O===Ca(OH)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com