
题目列表(包括答案和解析)
2.2004年4月16日,重庆天原化工总厂发生氯气泄漏及爆炸特大事故,喷出的氯气造成了多人伤亡。作为消防干警在现场的下列处理方法和过程较合理的是 ( )
①及时转移疏散人群,同时向有关部门如实报告事故有关情况
②被转移人群应戴上用浓NaOH处理过的口罩 ③用高压水枪向空中喷洒含碱性物质的水溶液 ④被转移人群可戴上用Na2CO3处理过的口罩(湿润) ⑤将人群转移到地势较低的地方即可,不必走太远 ⑥及时清理现场,检查水源和食物等是否被污染 ⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒
A.②③④⑤ B.①③④⑥
C.①②⑤⑥ D.①③⑤⑦
[解析] NaOH为强碱有强腐蚀性,②不合理。Cl2的密度比空气大,⑤不合理。Cl2的溶解度不大且溶于水生成HCl,⑦不合理。
[答案] B
1.自来水常用Cl2消毒,某学生在实验室用这种自来水去配制下列物质的溶液,不会产生明显药品变质问题的是 ( )
①AgNO3 ②FeCl3 ③Na2SO3 ④AlCl3 ⑤FeCl2 ⑥NaHCO3
A.①②③ B.②③④
C.③④⑤ D.②④
[解析] Cl2通入水后,溶液中含有H2O、Cl2、HClO、H+、Cl-、ClO-、OH-,其中Cl2、HClO能氧化具有还原性的Na2SO3、FeCl2;Cl-与Ag+反应生成AgCl白色沉淀;H+能与碱性物质,如NaHCO3反应。
[答案] D
21.(7分)向100 mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应,如下图所示表示加入固体的质量与产生气体的体积(标准状况)的关系。试通过计算填写下列空格:
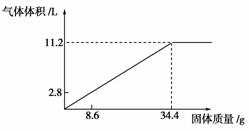
(1)NaOH溶液的物质的量浓度是________mol·L-1。
(2)当NaOH溶液为140 mL时,加入固体为51.6 g,充分反应所产生的气体为________L(标准状况)。
(3)当NaOH溶液为180 mL时,加入的固体仍为51.6 g,充分反应所产生的气体为________L(标准状况)。
[解析] 反应的离子方程式为NH+OH-NH3↑+H2O,n(OH-)=n(NH3)=11.2 L÷22.4 L·mol-1=0.5 mol,
(1)c(NaOH)=c(OH-)=0.5 mol÷0.1 L=5 mol·L-1;
(2)由100 mL NaOH溶液最多溶解34.4 g固体可知:140 mL溶液最多可溶解1.4×34.4 g=48.16 g固体混合物,充分反应所产生的气体体积为1.4×11.2 L=15.68 L(标准状况);
(3)180 mL溶液最多可溶解1.8×34.4 g=61.92 g固体混合物,此时只有51.6 g固体,故此时NaOH溶液过量,应根据51.6 g固体的量计算生成气体的体积应为51.6 g÷34.4 g×11.2 L=16.8 L。
[答案] (1)5 (2)15.68 (3)16.8
20.(9分)一含有两种阳离子和一种阴离子的结晶水合物,现称取两份质量均为1.96 g的该结晶水合物,配制成溶液。一份中加入足量Ba(OH)2溶液,生成白色沉淀随即沉淀转变为灰绿色,最后变为红褐色。过滤后,沉淀物用盐酸处理经洗涤、干燥得白色固体2.33 g,而加热滤液时,逸出能使湿润红色石蕊试纸变蓝色的气体。另一份用0.10 mol·L-1酸性KMnO4溶液滴定,达到终点时,消耗KMnO4溶液10.0 mL,MnO恰好完全转化为Mn2+。请回答以下问题:
(1)写出KMnO4溶液与待测液反应的离子方程式:____________________________________。
(2)0.10 mol·L-1的KMnO4溶液盛在________(填“酸式”或“碱式”)滴定管中,待测液盛在锥形瓶里,到达滴定终点的标志是__________________________________。
(3)该结晶水合物中含有的离子是________、________、________(写离子符号)。
(4)通过计算确定该结晶水合物的化学式:________________________________________________________________________。
[解析] (2)KMnO4具有强氧化性,能腐蚀橡胶,故不能盛放在碱式滴定管中,应盛放在酸式滴定管中;由于KMnO4溶液本身显紫红色,可作为反应的指示剂,当刚好出现淡红色且半分钟内不褪色时,说明到达滴定终点。(3)根据题意可以判断原物质中含有的离子是:Fe2+、NH、SO。(4)由5Fe2+-MnO得,n(Fe2+)=5n(MnO)=5×10.0×10-3 L×0.10 mol·L-1=0.005 mol;n(SO)=n(BaSO4)==0.01 mol;根据离子化合物中阴、阳离子电荷守恒原理:n(NH)+2n(Fe2+)=2n(SO)可得:n(NH)=0.01 mol;根据质量守恒:m(H2O)=1.96 g-0.01 mol×18 g/mol-0.005 mol×56 g/mol-0.01 mol×96 g/mol=0.54 g,n(H2O)==0.03 mol,故该结晶水合物的化学式为:(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4·FeSO4·6H2O。
[答案] (1)5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(2)酸式 溶液刚好出现淡红色且半分钟内不褪色
(3)Fe2+ NH SO
(4)(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4·FeSO4·6H2O
19.(12分)各地电视台的天气预报中都要预报城市的空气质量。预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为八个等级。目前测定空气中SO2含量时主要用一些氧化还原反应。
已知:SO2气体与酸性KMnO4溶液反应时,MnO被还原为Mn2+,SO2被氧化为SO。现有药品:KMnO4固体、颗粒吸附剂、品红试纸、pH试纸、1 mol/L的稀硫酸、蒸馏水等。
问题 你怎样测定空气中SO2的含量和可吸入颗粒的含量?
猜想 取一定体积(一定质量)的空气样品,然后让其通过酸性高锰酸钾溶液,根据MnO(紫红色)→Mn2+(无色)颜色变化,确定SO2的含量;同样让样品通过固体吸附剂,来测定可吸入颗粒的含量。首先配制酸性高锰酸钾溶液,称量吸附剂和盛放吸附剂仪器的总质量。
设计和实施方案
(1)配制200 mL 0.1 mol/L的酸性KMnO4溶液需用的仪器有________________、________________、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是搅拌和________,注意在向容量瓶中加蒸馏水之前应加入________________。
(2)SO2与酸性KMnO4溶液反应的离子方程式为__________________________________。若气体的流速为a cm3/min,当t min时,200 mL 0.1 mol/L的酸性溶液恰好褪色,则空气中SO2的含量为________g/cm3。
(3)空气中可吸入颗粒一般用固体吸附剂吸附,若要测定其含量,需要测出的数据有________________________________________________________________________
________________________________________________________________________。
(4)空气中SO2的含量还可用检测管测定,其原理是:SO2与试剂KIO3发生作用,可能发生的反应(未配平)有:①KIO3+SO2+H2O―→I2+H2SO4+KHSO4;②KIO3+SO2+H2O―→KI+H2SO4。设计检气管的原理是按照上述两个化学方程式中的方程式________(填“①”或“②”)设计的,理由是__________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] (1)配制酸性KMnO4(aq),要向溶液中加入一定量的稀硫酸。
(2)V(空气总)=at cm3,m(SO2)=0.2 L×0.1 mol/L××64 g/mol=3.2 g⇒SO2的含量为: g/cm3。
(3)吸收前后固体吸附剂和盛放吸附剂仪器的总质量。
[答案] 设计和实验方案
(1)200 mL容量瓶 托盘天平(带砝码) 引流 5 mL的1 mol/L的稀硫酸(5 mL不是确定数)
(2)5SO2+2MnO+2H2O===2Mn2++5SO+4H+
(3)吸收前后固体吸附剂和盛放吸附剂仪器(如干燥管)的总质量
(4)① 该反应前后溶液的颜色发生变化,能指示终点
18.(12分)某一种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液;②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20 mL蒸馏水;③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,需用去Vx mL达滴定终点;④加入25 mL 0.1 mol·L-1的HCl溶液。
(1)写出全部实验过程的步骤____________________________________(填序号)。
(2)下图所示的仪器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是________(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称)。
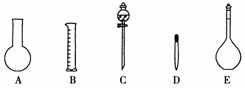
(3)配制上述溶液应选用的容量瓶规格分别为________(填字母)。
A.50 mL,50 mL B.100 mL,100 mL
C.100 mL,150 mL D.250 mL,250 mL
(4)写出相关的化学反应方程式: _______________________________________
________________________________________________________________________。
(5)胃药中含碳酸钙的质量为:________________________g(写出计算式并加以文字说明)。
[答案] (1)①②④③②④③或②①④③②④③
(2)AC 烧杯、玻璃棒 (3)B
(4)CaCO3+2HCl===CaCl2+CO2↑+H2O
HCl+NaOH===NaCl+H2O
(5)平行操作实验2-3次:0.125-或0.125-
17.(12分)(2008年江苏)配制一定物质的量浓度的溶液是实验室进行科学研究的重要环节。
(1)若配制大约1 mol·L-1的溶液100 mL,所给仪器只有托盘天平、量筒、带刻度的烧杯、玻璃棒,下列可选用的试剂是________(填字母序号)。
A.氢氧化钠固体 B.浓硫酸(98%)
C.浓盐酸(37%) D.浓硝酸(63%)
(2)下图是某学生在配制0.100 mol·L-1的碳酸钠溶液100 mL时,将第一次洗涤液转移到容量瓶内的操作。

该步骤对所得溶液浓度的影响是________(填“偏高”、“偏低”或“无影响”),原因是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)若配制(2)中溶液时,该学生使用托盘天平称取碳酸钠,则与计算量一致吗?为什么?
______________________________________________________________________________________________。
[答案] (1)ABCD (2)偏低
①玻璃棒紧靠容量瓶口造成洗涤液外溢
②玻璃棒从容量瓶移出时,残留在玻璃棒上的洗涤液可能滴在瓶外 ③玻璃棒移出后直接放在桌面上,造成残留洗涤液损失
④玷污玻璃棒
(3)不一致,因为Na2CO3的计算量为1.06 g,而托盘天平只能准确到0.1 g,只能称取碳酸钠1.1 g
16.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和b mol·L-1。则a与b的关系为 ( )
A.a=b B.a=2b
C.2a=b D.a=5b
[解析] n(CuO)∶n(MgO)=∶=∶=1∶2,体积相同时,物质的量比等于物质的量浓度比,所以==⇒2a=b,故选C。
[答案] C
第Ⅱ卷 (非选择题,52分)
15.体积为V mL、密度为ρ g·mL-1的含有相对分子质量为M的某物质的溶液,其中溶质为m g,其物质的量浓度为c mol·L-1,溶质的质量分数为w%,则下列表示不正确的是
( )
A.c= B.m=
C.w%=×100% D.c%=
[解析] 根据物质的量浓度与质量分数的换算可知c,再由体积、密度、质量的换算求m。
故A:c=,错误。
B:m=Vρ·w%=,正确。
C:w%=×100%=×100%,正确。
D:c==,正确。
[答案] A
14.现将质量分数为x%的H2SO4和3x%的H2SO4等体积混合,所得混合液的质量分数为m%,则m与x的关系为 ( )
A.m=2x B.m<2x
C.m>2x D.无法判断
[解析] 由于V≠V1+V2,当两种H2SO4的体积均设为V mL,密度分别为ρ1 g/cm3和ρ2 g/cm3时,则有:
m%==x%
因为H2SO4溶液的密度随着其质量分数的增大而增大,故ρ2>ρ1,即:>1,所以m%>2x%,即m>2x。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com