
题目列表(包括答案和解析)
12.根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。

(1)单质L是______________。
(2)化合物B是______________。
(3)图中除反应①以外,还有两个用于工业生产的反应,是______________和__________(填代号)。它们的化学反应方程式分别是________________________________________________________________________
和________________________________________________________________________。
[解析] 在中学化学常见的重要反应中,工业上按分解反应类型来生产物质的反应,很容易想到用碳酸钙分解反应制备CaO和CO2;经反应⑤检验E,同时又生成CaCO3则E为CO2,G为Ca(OH)2,B为H2O;又有反应②电解A的水溶液得到三种物质,结合电解原理知,A和H2O中各有一种离子在电极上放电而得到两种单质,又H可与Ca(OH)2反应又生成三种物质,不难联想到工业上制取漂白粉的反应原理2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,则H为Cl2,A为NaCl,L为H2,反应的化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑
[答案] (1)H2 (2)H2O (3)②④
2NaCl+2H2O2NaOH+H2↑+Cl2↑
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
11.(2008年天津理综)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为________________________________________________________________________。
(3)X的硝酸盐水溶液显________性,用离子方程式解释原因:______________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________________________________________________________________。
(5)比较Y、Z气态氢化物的稳定性:________>________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________>________>________>________。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式: _________________。
[解析] 本题以元素周期律为依据考查几种常见元素的性质。解题的突破口在第(1)中W、X两种元素最高价氧化物的水化物可以反应生成盐和水,说明W是钠,X是铝。在(2)中W与Y可形成W2Y,说明Y为-2价,应为硫元素,原子序数Y<Z,说明Z为氯元素,元素推出后,其相关的问题就不难做答。
[答案] (1)Al(OH)3+OH-===AlO+2H2O
(2)Na+[······ ··]2-Na+
(3)酸 Al3++3H2O
 Al(OH)3+3H+
Al(OH)3+3H+
(4)SO2+Cl2+2H2O===H2SO4+2HCl
(5)HCl>H2S (6)S2->Cl->Na+>Al3+
(7)Cl2O7(l)+H2O(l)===2HClO4(aq);ΔH=-4Q kJ·mol-1
10.实验室制Cl2的反应为4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,下列说法错误的是 ( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 mol Cl2,转移电子的物质的量为2 mol
C.每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
[答案] C
9.(2008年天门模拟)今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1 mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体n mol,在乙瓶中加入少量的NaHSO3晶体n mol,丙瓶不变,片刻后,甲、乙、丙三瓶溶液中HClO的物质的量浓度大小关系是(假设溶液体积不变) ( )
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲=乙 D.乙>丙>甲
[解析] 氯水中存在Cl2+H2O
 HCl+HClO平衡,加入NaHCO3与HCl反应,促使平衡右移,HClO浓度增大。加入NaHSO3与Cl2反应,促使平衡左移,HClO浓度减小。
HCl+HClO平衡,加入NaHCO3与HCl反应,促使平衡右移,HClO浓度增大。加入NaHSO3与Cl2反应,促使平衡左移,HClO浓度减小。
[答案] B
8.已知KMnO4与浓HCl在常温下反应能产生Cl2。若用如下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是(不考虑①单元装置) ( )
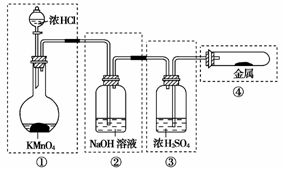
A.只有①和②处 B.只有②处
C.只有②和③处 D.只有②、③、④处
[解析] ①是制备氯气的装置 ②是除去氯气中氯化氢杂质的装置 ③是干燥装置 ④是用于氯气与金属反应的装置。除杂时不能消耗欲保留的气体,因为氯气可与NaOH溶液反应,方程式为:Cl2+2NaOH===NaCl+NaClO+H2O,所以②处错误;③中进气管短,出气管却插入液面下,所以无法干燥气体也不能使气体进入④中与金属反应,所以③处错误;④是一个封闭体系,未反应的气体不断蓄积会使容器内压强过大而发生爆炸,所以④处错误。
[答案] D
7.如下图所示装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于 ( )
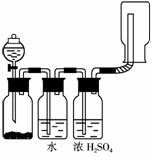
A.锌和盐酸生成氢气
B.二氧化锰和浓盐酸生成氯气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
[答案] A
6.(2008年北京东城二摸)已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如下图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是 ( )
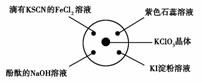
|
选项 |
实验现象 |
结论 |
|
A |
滴有KSCN的FeCl2溶液变红 |
Cl2具有还原性 |
|
B |
滴有酚酞的NaOH溶液褪色 |
Cl2具有酸性 |
|
C |
石蕊溶液先变红后褪色 |
Cl2具有漂白性 |
|
D |
淀粉KI溶液中变蓝 |
Cl2具有氧化性 |
[解析] A项说明Cl2具有氧化性。B项是Cl2先与H2O反应生成了酸。C项是Cl2与H2O反应生成的HClO具有漂白性。D项的反应为Cl2+2KI===2KCl+I2,说明Cl2具有氧化性。
[答案] D
5.将0.03 mol Cl2缓缓通入含有0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程中c(H+)与Cl2用量的关系是 ( )
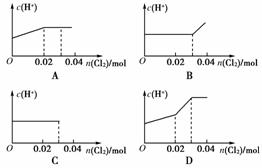
[解析] Cl2先与H2SO3反应,此过程中H+浓度逐渐增大,当HBr与Cl2反应时H+的浓度没有明显变化。
[答案] A
4.亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2===4ClO2↑+HCl+2H2O,ClO2是广谱型消毒剂。下列说法正确的是
( )
A.HClO2是有机酸
B.上述反应中,ClO2是还原产物
C.上述反应中,1 mol HClO2分解转移2 mol电子
D.上述反应中,氧化剂与还原剂的物质的量之比为1∶4
[解析] HClO2中Cl的化合价为+3,ClO2中Cl的化合价为+4,故ClO2属于氧化产物;5 mol HClO2分解时转移4 mol e-,故1 mol HClO2分解应转移0.8 mol e-。
[答案] D
3.下列关于漂白粉的叙述中,正确的是 ( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空气中久置后能变质
C.漂白粉的溶液呈中性
D.在使用漂白粉时应用浓盐酸
[解析] 漂白粉是CaCl2和Ca(ClO)2的混合物,但其有效成分为Ca(ClO)2,A错;漂白粉在空气中发生以下反应而变质:
Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO
2HClO2HCl+O2↑,B正确;Ca(ClO)2为强碱弱酸盐,水解后显碱性,C错;漂白粉使用时不能用浓盐酸,因为会发生氧化还原反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O D错。
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com