
题目列表(包括答案和解析)
9.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量的镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是 ( )
A.镁粉只能直接与溴水中的溴反应
B.水是镁粉与溴发生反应的催化剂
C.产生极少量的气泡是由镁粉与水反应得到
D.镁粉与溴水中的酸发生反应,导致平衡移动使溴水褪色
[解析] 由①③说明Mg与H2O、Br2很难反应,则④说明水为Mg与溴反应的催化剂。
[答案] B
8.(2008年安阳模拟)向2 mL 0.5 mol·L-1的FeCl3溶液中加入3 mL 5 mol·L-1 KF溶液,发现FeCl3溶液逐渐褪至无色,再加入KI溶液和CCl4振荡后,静置,不见CCl4层有紫红色,则下列说法正确的是 ( )
A.Fe3+不与I-发生反应
B.Fe3+与F-结合生成不与I-反应的物质
C.F-使I-的还原性减弱
D.Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
[解析] 由题中信息可知,FeCl3溶液与KF溶液发生了反应,而且生成物不与I-反应,故B正确。
[答案] B
7.下列关于砹(85At)及其化合物的说法中,正确的是 ( )
A.稳定性:HAt>HCl
B.氧化性:At2>I2
C.At2为分子晶体
D.NaAt的水溶液呈碱性
[解析] HAt水溶液的酸性应比氢碘酸(强酸)还强,故NaAt的水溶液呈中性。
[答案] C
6.下列实验中,没有置换反应发生的是 ( )
A.镁条插入浓NH4Cl溶液中
B.溴水滴入KI溶液中
C.铝片插入浓NaOH溶液中
D.0.01 mol Cl2通入100 mL 2 mol·L-1 FeBr2溶液中
[解析] Mg与NH水解产生的H+发生置换反应;铝与浓NaOH溶液的反应实际上是铝和水之间发生置换反应,生成Al(OH)3迅速被NaOH溶解。
[答案] D
5.碱金属与卤素所形成的化合物大都具有的性质是 ( )
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点⑤熔融状态不导电
A.①②③ B.③④⑤
C.①④⑤ D.②③⑤
[解析] 碱金属为活泼金属元素,卤素为活泼非金属元素,它们一般生成离子化合物,构成离子晶体,性质上一般都是高熔、沸点,易溶于水,水溶液能导电,熔融态也导电。
[答案] A
4.下列物质的保存方法正确的是 ( )
A.氢氟酸保存在带塑料塞的玻璃瓶中
B.氢氧化钠溶液盛放在带玻璃塞的玻璃瓶中
C.氯水储存于棕色玻璃瓶中
D.硅酸钠溶液密封保存在带玻璃塞的玻璃瓶中
[解析] A项,氢氟酸能腐蚀玻璃;B项,玻璃中成分SiO2与NaOH溶液反应生成具有粘性的Na2SiO3;C项,HClO见光易分解,故用棕色瓶盛装;D项,Na2SiO3溶液具有粘性,使瓶塞和瓶体粘结在一起。
[答案] C
3.R代表氢元素或钠元素,与RF<RCl<RBr<RI的变化规律不符的卤化物的性质是
( )
A.卤化氢的热稳定性
B.遇氧化剂时表现出的还原性强弱
C.与硝酸银溶液反应生成的沉淀颜色深浅
D.卤化氢水溶液的酸性
[解析] 本题主要依据卤素单质及化合物性质递变规律进行分析作答。A项,卤化氢的热稳定性HF>HCl>HBr>HI;B项,卤化氢(或卤素阴离子)的还原性HF<HCl<HBr<HI(或F-<Cl-<Br-<I-);C项,AgF不沉淀,从Cl→I,卤化银沉淀的颜色由白→浅黄→黄逐渐变深;D项,从F→I元素非金属性逐渐减弱,因此卤化氢水溶液酸性HF<HCl<HBr<HI。
[答案] A
2.下列说法,违反科学原理的是 ( )
A.碘化银可用于人工降雨
B.闪电时空气中的N2可变为氮的化合物
C.添加少量某物质可将水变成燃料油
D.在一定温度、压强下石墨可变成金刚石
[答案] C
1.下列对溴化钠的描述中,正确的是 ( )
A.是一种可溶于水的晶体,熔点较高
B.跟AgNO3溶液反应将生成白色沉淀
C.跟浓硫酸反应是制取溴化氢气体的常用方法
D.其工业制法之一是将金属钠跟单质溴反应
[解析] 溴化钠是一种离子晶体,可溶于水,且熔点较高;其中溴离子可与银离子结合生成浅黄色的溴化银沉淀;溴离子能被浓硫酸氧化为单质的溴,所以常用浓磷酸与溴化钠反应制取溴化氢;自然界中溴以化合态存在,用单质钠与单质溴反应制溴化钠的经济成本太高。
[答案] A
13.某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
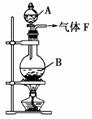
(1)A是浓盐酸,B是二氧化锰,将A滴入B中时发生反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12 L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:________________________________________。
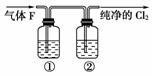
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①__________,②________________(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224 mL(标准状况下)Cl2完全反应,则反应过程中转移电子的物质的量为________。
[解析] (1)二氧化锰氧化浓盐酸可以制取氯气,离子方程式为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(2)浓盐酸浓度变小是因为二氧化锰和浓盐酸反应过程中消耗HCl,加热时氯化氢挥发,生成的水稀释浓盐酸。(3)制取的氯气中含有氯化氢和水蒸气,净化时应先通过饱和食盐水或水吸收氯化氢,后通过浓硫酸吸收水蒸气。(4)反应2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O中,1 mol Cl2参加反应转移1 mol电子,故通入224 mL(标准状况下)Cl2完全反应,反应过程中转移电子0.01 mol。
[答案] (1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)①氯化氢挥发;②反应生成水;③反应消耗HCl
(3)饱和食盐水或水 浓硫酸
(4)0.01 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com