
题目列表(包括答案和解析)
5.向100 mL FeCl2溶液中滴入含Br2 0.05 mol的溴水,测得加入的溴已完全反应,形成的溶液不含Fe2+,则原FeCl2溶液的物质的量浓度为 ( )
A.0.5 mol·L-1 B.1 mol·L-1
C.1.5 mol·L-1 D.2 mol·L-1
[解析] 由关系式2Fe2+-Br2知c(FeCl2)×100×10-3 mol∶0.05 mol=2∶1,即c(FeCl2)=1 mol·L-1。
[答案] B
4.通过置换反应不可能生成 ( )
A.Fe3O4 B.F2
C.Al2O3 D.C
[解析] F2是氧化性最强的单质,没有哪种单质能从其氟化物中置换出来,对A,反应为3Fe+4H2O(g)Fe3O4+4H2;对C,反应为2Al+Fe2O3Al2O3+2Fe;对D,反应为2Mg+CO22MgO+C。
[答案] B
3.化学与人们的生活、健康密切相关。下列做法不合理的是 ( )
A.用米汤检验加碘食盐中的碘酸钾(KIO3)
B.向豆浆中加入盐卤(主要成分为MgCl2)制作豆腐
C.用灼烧和闻气味的方法区别棉织物和纯毛织物
D.用透析的手段净化尿毒症患者的血液
[解析] 米汤中含有淀粉,KIO3遇淀粉不会变蓝,没有现象产生,A项不正确。
[答案] A
2.下列物质能通过化合反应直接制得的是 ( )
①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③
C.只有①③④ D.全部
[解析] 本题主要考查元素化合物的性质,由反应2FeCl3+Fe===3FeCl2,SO3+H2O===H2SO4,NH3+HNO3===NH4NO3,H2+Cl22HCl知所给物质皆可通过化合反应制得。
[答案] D
1.氯气是有毒的,曾被法西斯制成毒气弹用于侵略战争。当这种毒气弹顺风爆炸时,通常可用的防御方法是 ( )
A.人、畜应躲到低洼的地方
B.人、畜应到较高的地方去
C.人、畜应多饮豆浆和牛乳
D.可用肥皂水浸湿软布蒙面
[解析] 氯气的密度比空气大,故人、畜应到较高的地方去,又因为Cl2能被碱性溶液吸收,故B、D正确。
[答案] BD
14.下图是关于药物华素片(西地碘片)使用说明书中的部分内容:
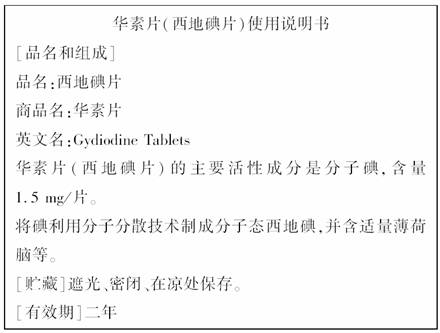
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是________(填分子式);
②请推断:华素片________(填“是”或“不是”)白色的。
(2)某学生为验证华素片中确实含有上述成分,完成实验如下。
请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向该试管中再加入约2 mL________(填字母),并再用力振荡。
A.酒精 B.裂化汽油
C.四氯化碳 D.甘油
②描述加入该液体后可能观察到的现象_______________________________________
________________________________________________________________________。
③选用该液体做实验的原因是 _________________________________________
________________________________________________________________________。
(3)请再设计另一种方法,验证华素片中的成分(注意叙述实验原理、操作方法和实验结论)________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] 本题是以I2的基本性质为载体的实验探究题,综合考查碘单质的性质,包括颜色,碘水颜色,碘的有机溶剂颜色,以及萃取剂选择的理由,都属一些识记性知识。
[答案] (1)I2 不是 (2)C 溶液分上下两层,上层无色,下层紫红色 碘单质在水中溶解度很小,在CCl4中溶解度较大,且CCl4与水互不相溶 (3)取一粒华素片,研碎后加入试管中并加入约2 mL蒸馏水,振荡后加入少许淀粉,如呈现蓝色,说明有单质碘的存在
13.已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是__________,Z是________。
(2)写出③中反应的化学方程式____________________________________________。
(3)写出④中反应的化学方程式_____________________________________________。
[解析] 本题是元素化合物的推断题,做题的方法一般是先寻找突破口,结合所学知识,大胆猜测,然后再验证。由已知①、③可知:单质A与一元强碱发生的是歧化反应。A一定为非金属,结合所学知识,A应该是Cl2。由已知④,可使人自然想到KClO3的受热催化分解制O2,至此本题答案已明确。
[答案] (1)Cl(或氯) K(或钾)
(2)Cl2+2KOH===KCl+KClO+H2O
(3)2KClO3MnO2△2KCl+3O2↑
12.(2008年重庆理综)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________;X与氢元素形成的化合物的电子式是________________________________________________________________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为
________________________________________________________________________。
[解析] (1)54÷3=18,即在XY2中阴阳离子核外电子数均为18,X为Ca,Y为Cl;(2)最外层电子数是电子层数2倍的前20号元素有He、C、S,其中硫与氯相邻,故D为硫,由S与E能形成非极性分子,可得E为碳,二者形成的化合物CS2,其结构和CO2类似;氧族元素中由于水分子间氢键的存在,其沸点反常,所以氧族元素氢化物沸点最低的是H2S;(3)由题意可知W为Si,Z为N,由硅和氮的化合价可知二者形成的化合物的化学式为Si3N4;(4)与氯同主族前20号元素只有氟,依据题目给定的产物OF2和原子守恒、电荷守恒原理写出离子方程式。
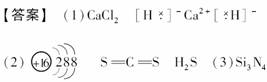
(4)2F2+2OH-===2F-+OF2+H2O
11.溴水和稀碘水均呈黄色。(1)若用物理方法鉴别,应选用________作试剂,现象__________________,相应的结论:____________________________________________
________________________________________________________________________。
(2)若用化学方法鉴别,可以选用____________试剂,现象________________________________________________________________________
________________________________________________________________________,
结论:________________________________________________________。
[答案] (1)苯(或CCl4) 向两种试液中分别加入5 mL苯(或CCl4)后溶液分层 上层(或下层)呈紫红色的是碘水,上层(或下层)呈现橙红色的是溴水
(2)淀粉溶液 向两种试液中分别加入淀粉溶液后,一样品溶液出现蓝色,另一样品无明显变化 则呈蓝色的是碘水,无变化的是溴水
10.IF5与卤素单质的化学性质相似,下列有关IF5的叙述中不正确的是 ( )
A.IF5是由极性键形成的共价化合物
B.IF5可与H2O发生反应生成HIO3和HF
C.IF5有较强的还原性
D.IF5与H2O反应属于非氧化还原反应
[解析] IF5是由两种典型非金属形成的化合物,只能形成共价键,其中F的非金属性强于I,所以F显-1价,I显+5价,在与水反应时,实际上是发生水解反应,IF5+3H2O5HF+HIO3,各元素的化合价均没有变化。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com