
题目列表(包括答案和解析)
4.对相同状况下的12C18O和14N2两种气体,下列说法正确的是 ( )
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
[解析] A项,12C18O与14N2的相对分子质量不相等,当它们的质量相等时,分子数不相等,质子数不相等。B项,1个12C18O分子的中子数为6+10=16,1个14N2分子的中子数为14个,故原子数相等(此时分子数也相等),中子数不相等。C项是阿伏加德罗定律的直接应用。D项,密度之比等于相对分子质量之比为30∶28=15∶14。
[答案] C

[解析] U原子核中的质子数为92,中子数为235-92=143,核外电子数为92,它与U的质子数相同,而中子数不同,二者互为同位素而不是同素异形体。
[答案] C
3.下列叙述错误的是 ( )
A.13C和14C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
[解析] 从元素、核素、同位素的概念,原子中质量数=质子数+中子数,原子序数=核电荷数=质子数=核外电子数等基础知识中可以发现D错误。
[答案] D
2.(2008年上海)在一定条件下,完全分解下列某化合物2 g,产生氧气1.6 g,此化合物是 ( )
A.1HO B.2HO
C.1HO D.2HO
[解析] 由A、B项,2HO===2H2↑+16O2↑
2M 32
2 1.6
可得M=20,B正确;
由C、D项2HO===2H2↑+18O2↑
2M 36
2 3.2
可得M=11.25,C、D项均不符合题意。
[答案] B
1.(2008年广东)2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于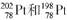 的说法正确的是 ( )
的说法正确的是 ( )
A.Pt和Pt的核外电子数相同,是同一种核素
B.Pt和Pt的中子数相同,互称为同位素
C.Pt和Pt的质子数相同,互称为同位素
D.Pt和Pt的质量数不同,不能互称为同位素
[解析] 同位素是指质子数相同而中子数不同的同一元素的不同核素。A项中Pt和Pt为同一元素的不同核素;B项中Pt的中子数为124,Pt的中子数为120;D项中Pt和Pt虽质量数不同,但质子数相同,应互称为同位素。
[答案] C
21.(18分)(2009年天津理综)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
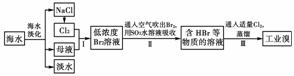
(1)请列举海水淡化的两种方法:__________、____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、______、______或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为____________________________________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是__________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
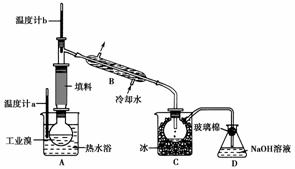
请你参与分析讨论:
①图中仪器B的名称:________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是______________。
[解析] (2)电解NaCl溶液:2NaCl+2H2OH2↑+Cl2↑+2NaOH,由以上反应生成的Cl2和NaOH进一步反应:Cl2+2NaOH===NaCl+NaClO+H2O,也可得到H2和NaClO。
(3)步骤Ⅰ中获得低浓度Br2溶液,再经过步骤Ⅱ、Ⅲ可富集溴元素。(4)SO2与Br2发生氧化还原反应:SO2+Br2+2H2O===H2SO4+2HBr,产物是两种强酸,故在工业生产中要注意强酸对设备的严重腐蚀。(5)由已知信息Br2的强腐蚀性可得出Br2腐蚀橡胶,故装置中不能用橡胶塞和橡胶管。再由Br2的沸点59 ℃可知用该套装置提纯溴关键要控制温度计b的温度,收集59 ℃时的馏分。C中收集到的是深红棕色的液溴,要除去该产物中残留的少量Cl2,可向其中加入NaBr充分反应后,利用Br2易溶于CCl4的性质进行分液来分离,或利用Br2易挥发的特点用蒸馏法分离。
[答案] (1)蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O===4H++SO+2Br-
强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59 ℃时的馏分 ④深红棕色 分液(或蒸馏)
20.(10分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
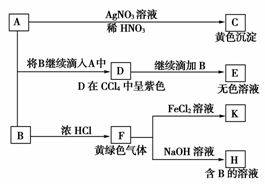
请回答:
(1)写出A、B和C的化学式:A________,B________,C________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:________________________________________________________________________;
________________________________________________________________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
________________________________________________________________________。
(4)写出由F→H的化学方程式:
________________________________________________________________________。
[解析] 本题通过无机化合物之间的网络图来考查相关的元素及其重要化合物知识的掌握程度并以此为依托考查学生分析、归纳、总结的思维能力。题中黄绿色气体F必为Cl2,据Cl2+2NaOH===NaCl+NaClO+H2O可知H为NaCl、NaClO的混合液,因其中的B呈碱性并具有氧化性可知B为NaClO。因为C为AgI,所以A为NaI,则D为I2,由此其余问题可解。
[答案] (1)NaI NaClO AgI
(2)2I-+ClO-+H2O===I2+Cl-+2OH-;
I2+5ClO-+2OH-===2IO+5Cl-+H2O
(3)2Fe3++SO2+2H2O===2Fe2++SO+4H+
(4)Cl2+2NaOH===NaClO+NaCl+H2O
19.(8分)如图中各物质均由常见元素(原子序数≤20)组成。已知A、B、K为单质,且在常温下A和K为气体,B为固体。D为常见的无色液体。I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如图所示(图中反应条件未列出)。
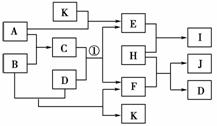
请回答下列问题:
(1)I的化学式为________;J的电子式为________。
(2)反应①的化学方程式为_________________________________________________。
(3)F的水溶液与氯气反应的离子方程式为___________________________________
________________________________________________________________________。
[解析] 由信息可推知,D为H2O,I是一种化肥且含氯,另由A+K―→E,E+H―→I,可推知I为NH4Cl。又由H+F―→J+H2O推知J这种干燥剂是CaCl2,H为HCl,F为Ca(OH)2,进而推知E为NH3,又C+H2O―→NH3+Ca(OH)2,A+B―→C,从而推知C为Ca3N2。
[答案]

(2)Ca3N2+6H2O===3Ca(OH)2+2NH3↑
(3)Cl2+2OH-===ClO-+Cl-+H2O
18.(10分)实验室用浓盐酸和MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
温度稍高即发生副反应:
6Cl2+6Ca(OH)2===Ca(ClO3)2+5CaCl2+6H2O
现有三个同学分别设计的三套实验装置,如下图所示:
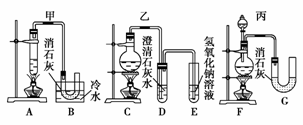
(1)请从a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境几个方面对上述甲、乙、丙三套装置的优、缺点作出评析,并选择符合题目要求的选项填在空格内。
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是______。
(3)实验中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是____________0.15 mol(填“大于”“小于”或“等于”),其原因是(假定各步反应均无反应物损耗,且无副反应发生) ____________________________________________
________________________________________________________________________。
[答案] (1)甲:d ae 乙:f ac 丙:b ce
(2)F-B-E
(3)小于 随反应进行,盐酸浓度小到一定程度后不再与MnO2作用,产生的氯气小于0.3 mol,最终生成的Ca(ClO)2也就小于0.15 mol
17.(6分)氯水可以跟KI溶液发生置换反应,过量的氯水可把I2氧化成碘酸,化学方程式为:
I2+5Cl2+6H2O===10HCl+2HIO3
碘酸是一种有光泽的白色晶体,极易溶于水,现有一瓶无色溶液,其中含有Br-和I-,以下仪器、药品可供选用:
药品:淀粉溶液、淀粉碘化钾溶液、氯水、四氯化碳
仪器:试管、烧杯、胶头滴管 、分液漏斗
请设计一个最简单的实验,用以证明该无色溶液中确实含有Br-和I-。
(1)实验步骤:
①________________________________________________________________________
________________________________________________________________________;
②________________________________________________________________________
________________________________________________________________________。
(2)所用仪器:________________________________________________________。
(3)选用药品:______________________________________________________________。
[答案] (1)①取少许溶液,滴加少量氯水,加入CCl4振荡后静置,CCl4层呈紫色,证明含有I-
②另取少量溶液,滴加过量氯水,加入CCl4振荡,静置,CCl4层显橙红色,证明含有Br-
(2)试管、胶头滴管 (3)氯水、四氯化碳
16.向用硫酸酸化的碘化钾溶液里加入过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕色,有关叙述有:①溶液里滴入淀粉液显蓝色;②逸出的气泡是HI;③离子方程式为H2O2+2I-===I2+O2+2H+;④离子方程式为H2O2+2I-+2H+===I2+2H2O;⑤反应时还有H2O2水解为水和O2。其中正确的是 ( )
A.①④⑤ B.①②④
C.③④⑤ D.①③⑤
[解析] HI是一种极易溶于水的物质,故在稀溶液里不会逸出HI气体,③中方程式电荷不守恒。
[答案] A
第Ⅱ卷 (非选择题,52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com