
题目列表(包括答案和解析)
1.(2009年北京理综)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是 ( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
[解析] W的最外层电子数与核外电子总数之比为7∶17,故W为氯元素,则X为氟元素,Y的原子序数为(9+17)÷2=13,为铝元素,由含Z元素的物质焰色反应为黄色知其为钠元素。根据元素周期律,Na的金属性比Al强;HF沸点比HCl高,是因为HF分子间存在氢键;Cl-的还原性比F-强;原子半径Na>Al>F,离子半径F->Na+>Al3+。
[答案] B
14.设X、Y、Z代表三种元素。已知:①X+和Y-两种离子具有相同的电子层结构 ②Z元素原子核内质子数比Y元素原子核内质子数少9个 ③Y和Z两种元素可以形成4核42个电子的负一价阴离子
据此,请填空:
(1)Y元素是__________,Z元素是________。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是________。
[解析] 依题意,假设元素Y的原子序数为y,则元素Z的原子序数为(y-9)。若以(YmZn)-表示由这两种元素所形成的4核42个电子的负一价阴离子,则下列关系式成立:
①×(xy)-②得,9n=4y-41,所以y= 。因n为整数,将其可能的取值1、2和3分别代入上式,经检验确定:n=3,y=17。所以,元素Y的原子序数为17,它是氯(Cl),而元素Z的原子序数为(17-9)=8,它是氧(O),进而可知元素X为钾(K),这三种元素所形成的含68个电子的盐的化学式为KClO4(所含电子数为:19+17+4×8=68)。
[答案] (1)氯 氧 (2)KClO4
13.A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子,其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性且为双原子分子。请回答:
(1)用化学符号表示上述5种微粒:
A_________,B_________,C_________,D_________,E_________。
(2)在水溶液中A跟B反应的离子方程式是:____________________________________。
[解析] (1)中学化学中18e-的物质有分子:Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6,阴、阳离子:S2-、Cl-、K+、Ca2+等。从题给信息“A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性”可以确定A是S2-,B是HCl,C是Cl-,D是H2S,E是F2。(2)在水溶液中A跟B反应的离子方程式是:S2-+2H+===H2S↑。
[答案] (1)S2- HCl Cl- H2S F2 (2)S2-+2H+===H2S↑
12.(2009年浙江理综)各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
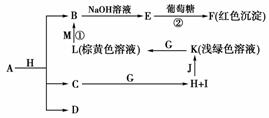
请回答下列问题:
(1)写出A的化学式______________,C的电子式________。
(2)比较Y与Z的原子半径大小________>________(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示) _________________________
________________________________________________________________________
________________________________________________________________________,
举出该反应的一个应用实例 ______________________
________________________________________________________________________
________________________________________________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:________________________________________________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称________、________、________。
[解析] 据题意,首先推出X为H,G为Cl2,反应①为2FeCl3+Cu===2FeCl2+CuCl2,即M为Cu,L为FeCl3,K为FeCl2,由转化关系可知,FeCl2由H与一金属反应得到,结合J为金属可知,J为Fe,H为HCl,I有漂白作用为HClO,则C为H2O,O最外层电子数为6,另一元素原子最外层电子数为4,因为X、Y、Z的原子序数依次增大,所以Y为C,Z为O。B→E→F这条线根据现象及葡萄糖参与反应可知F为Cu2O,E为Cu(OH)2,B为CuCl2,即A与HCl反应得CuCl2、H2O、CO2,所以A为CuCO3或碱式碳酸铜。(1)注意要求写A的化学式、水的电子式。(2)C与O属同周期元素,从左到右,原子半径随原子序数递增而减小。(3)葡萄糖是多羟基醛,与新制Cu(OH)2发生反应。方程式也可写为CH2OH(CHOH)4CHO+2Cu(OH)2+NaOHCH2OH(CHOH)4COONa+Cu2O↓+3H2O,实例可举医学上检验病人是否患糖尿病。(4)Cu2O与HNO3反应被氧化成Cu2+,同时生成无色气体NO,注意书写化学方程式后配平。(5)CO2被还原为C,据题意可知晶体N为金刚石,再写出其同素异形体。
[答案] (1)Cu2(OH)2CO3[Cu(OH)2·CuCO3]或CuCO3
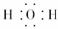 (2)C O
(2)C O
(3)CH2OH(CHOH)4CHO+2Cu(OH)2CH2OH(CHOH)4COOH+Cu2O↓+2H2O
医学上可用这个反应检验尿液中的葡萄糖
(4)3Cu2O+14HNO3(稀)===6Cu(NO3)2+2NO↑+7H2O
(5)金刚石 石墨 富勒烯(C60)或碳纳米管等
11.(2009年重庆理综)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为__________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为
________________________________________________________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y单质的电子式为________;Z分子的结构呈________。
②A的化学式是________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是__________________________________________。
[解析] 由(1)可知X应为Al;由(3)可知Z分子应为CH4或NH3或H2O或HF,但Z能与H2O2反应,只可能是NH3,所以Y应为N;(4)共四种元素,且均由两种元素组成,所以必生成两种化合物。
[答案]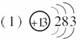
(2)Al3++4OH-===AlO+2H2O
(3)①∶N⋮⋮N∶ 三角锥形 ②AlN
(4)4Al+3TiO2+3C2Al2O3+3TiC
10.a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为: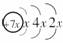 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为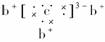 。下列比较中,正确的是 ( )
。下列比较中,正确的是 ( )
A.原子序数:a>b>c
B.其单质的活泼性:d>a>c
C.原子半径:c>a>d
D.其最高价含氧酸的酸性:d>c>a
[解析] a、b、c、d分别为Si、Na、P、N元素,N2很稳定,不如白磷活泼。Si、P、N的原子半径应为:Si>P>N。
[答案] D
9.原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X可能形成化学式为KXO3的含氧酸钾盐
C.X原子的最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
[答案] A
8.对于第n电子层若它作为原子的最外层,则容纳的电子数最多与(n-1)层相同,当它作为次外层,则其容纳的电子数比(n+1)层上的电子最多能多10个,则第n层为( )
A.L层 B.M层
C.N层 D.任意层
[解析] 当n+1层为最外层最多容纳8个电子,n层比(n+1)层多10个,即容纳18个2n2≥18,n≥3;当n为最外层时与(n-1)层容纳电子数相同,最外层最多容纳8个,(n-1)层容纳8个,n-1为第二层,则n=3。
[答案] B
7.下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数
A.①②④⑤ B.③④⑤⑥
C.②③⑤⑥ D.①②⑤⑥
[解析] ①中未说明粒子是单核还是多核;②中应为化学性质;⑤中一种元素可能有多种同位素,所以可能有多种质量数;⑥混淆了元素的相对原子质量与同位素的相对原子质量。
[答案] D
6.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于Y的说法不正确的是 ( )
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数为39
D.Y和Y是两种不同的核素
[答案] B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com