
题目列表(包括答案和解析)
0.2 mol 0.4 mol
所以n=2即ECl2中E显+2价。从ECl2的熔点、沸点数据特点可得出ECl2为非金属元素形成的分子晶体,A、B选项正确;C项中E元素呈多种价态,它的氧化物可以是EO2;D项中ⅣA族中的碳和硅不能形成ECl2型分子。
[答案] D
6.短周期元素E的氯化物ECln的熔点为-78 ℃,沸点为59 ℃;若0.2 mol ECln与足量的AgNO3溶液完全反应后可以得到57.4 g的AgCl沉淀。下列判断错误的是 ( )
A.E是一种非金属元素
B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2
D.E位于元素周期表的ⅣA族
[解析] 根据题意:n(AgCl)=57.4 g/143.5 g·mol-1=0.4 mol,
ECln - nAgCl
5.下列叙述正确的是 ( )
A.两种原子构成的共价化合物分子中的化学键都是极性键
B.两种不同非金属元素原子间形成的化学键都是极性键
C.含有非极性键的化合物分子一定不是极性分子
D.只要是离子化合物,其熔点就比共价化合物的熔点高
[解析] 由两种原子构成的共价化合物分子中的化学键不一定都是极性键,如乙烷分子中的C-C键、H2O2分子中的O-O键等,A不正确。含有非极性键的化合物分子有可能是极性分子,如含有O-O非极性键的H2O2分子是极性分子,C不正确。共价化合物可形成分子晶体,也可形成原子晶体,而原子晶体熔点一般都比离子晶体高,故D错。
[答案] B
4.下图所示中每条折线表示周期表ⅣA-ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是 ( )
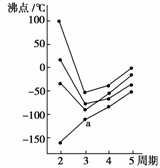
A.H2S B.HCl
C.PH3 D.SiH4
[解析] 因为第二周期的非金属元素的气态氢化物中,NH3、H2O、HF分子之间存在氢键,它们的沸点高于同族其他元素气态氢化物的沸点,A、B、C不合题意,而CH4分子间不能形成氢键,所以a点代表的是SiH4。
[答案] D
3.下列物质熔化或汽化时,所克服的微粒间作用力属同种类型的是 ( )
A.I2和NH4Cl受热汽化 B.SiO2和NaCl的熔化
C.干冰和液氧的汽化 D.HI和NH4Cl受热分解
[解析] 微粒间作用力主要有:离子键、共价键、分子间作用力(还有氢键)。微粒间作用力不同,则熔化或汽化时所克服的力也不同。A中固态碘汽化时只需克服分子间作用力,NH4Cl是离子化合物,且受热分解时克服的是离子键。B中SiO2是共价化合物,熔化时需克服共价键,NaCl是离子化合物。C中干冰和液氧汽化时只需克服分子间作用力。D中HI是共价化合物,由HI分子构成,但受热易分解生成H2和I2(气),这一变化过程必须经过旧化学键的断裂和新化学键的生成,克服的是共价键。NH4Cl受热分解克服的是离子键。
[答案] C
2.下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.六氟化氙(XeF6) B.次氯酸(HClO)
C.氯化硫(SCl2) D.三氟化硼(BF3)
[解析] A项因为Xe已达到8e-结构,与F共价后XeF6不能都满足8电子结构。
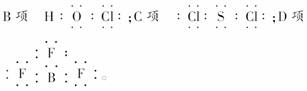
[答案] C
1.(2008年广东)元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是 ( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ2
[解析] 根据题意,符合条件的化合物有NaNO3和MgCO3两种。B项中MgCO3微溶于水,MgO为离子化合物。
[答案] B
14.X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中Z与Y相邻,Z与W也相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”):________,理由是________________________________________________________________________
________________________________________________________________________;
(2)Y是__________,Z是____________,W是__________;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式____________________________________________________。
[解析] 任取同周期连续相邻的三种元素Y、Z、W,其原子的最外层电子数之和均不可能等于17。根据原子序数关系X<Y<Z<W和它们的相邻关系,可知短周期中只有两种形式: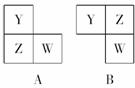 。设Z的原子最外层电子数为a,则有A型:Y、W原子最外层电子数分别是a、a+1,有a+a+a+1=17,
。设Z的原子最外层电子数为a,则有A型:Y、W原子最外层电子数分别是a、a+1,有a+a+a+1=17,
则a=,而最外层电子数必为整数,舍去。B型:Y、W原子最外层电子数分别为a-1,a,有a-1+a+a=17,则a=6,符合题意,所以Z为氧,Y为氮,W为硫。根据化合物中原子个数比X∶N∶O∶S=8∶2∶4∶1,以及N、O、S通常所显示的化合价判断可知价态、、,故X为+1价,由X的原子序数和化合价可推知其为氢元素,所以化合物为(NH4)2SO4。
[答案] (1)否 若三者处于同一周期,则最外层电子数之和不可能为17 (2)N O S
(3)硫酸铵;(NH4)2SO4
13.a、b、c、d、e是短周期元素,周期表中a与b、b与c相邻;a与e的最外层电子数之比为2∶3,b的最外层电子数比e的最外层电子数少1个;常见化合物d2c2与水反应生成c的单质,且溶液使酚酞试液变红。
(1)e的元素符号是________。
(2)a、b、c的氢化物稳定性顺序为(用分子式表示)________________;b的氢化物和b的最高价氧化物的水化物反应生成Z,则Z中的化学键类型为__________________,Z的晶体类型为________________;ab-离子的电子式为________。
(3)由a、c、d形成化合物的水溶液显碱性,其原因是(用离子方程式表示)________________________________________________________________________。
(4)一定量的d2c2与ac2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则用物质的量表示该固体物质的组成为________________、________________。
[解析] 从常见化合物d2c2与水反应生成c的单质、且溶液使酚酞试液变红可推知d2c2为Na2O2,c为氧元素,a与b,b与c相邻,则a最外层电子数必大于或等于4,而a与e的最外层电子数之比为2∶3,a、e所在的主族只能为ⅣA 和ⅥA族,a与b,b与c相邻,则a、b、c三种元素的原子序数是连续的。依次推出b为氮元素,a为碳元素,e为硫元素。从上述推断中可推知a、b、c的氢化物稳定性顺序为CH4<NH3<H2O,b的氢化物和b的最高价氧化物的水化物反应的产物为NH4NO3,其中化学键为离子键和共价键、晶体类型为离子晶体,CN-离子的电子式为[∶C⋮⋮N∶]-。a、c、d形成的化合物为Na2CO3或Na2C2O4其水溶液呈碱性的原因为CO+H2OHCO+OH-或C2O+H2OHC2O+OH-,d2c2与ac2反应后的固体恰与0.8 mol稀盐酸反应收集到0.25 mol气体,假定d2c2与ac2即Na2O2与CO2反应后的产物完全为Na2CO3,恰好与0.8 mol稀盐酸反应,应生成0.4 mol CO2,实际生成0.25 mol,说明有Na2O2剩余,产生的气体有O2,该固体的组成应为Na2CO3和Na2O2,根据差量法推知有Na2O2 0.3 mol、Na2CO3 0.1 mol。
[答案] (1)S (2)CH4<NH3<H2O 共价键和离子键 离子晶体 [··C⋮⋮N··]-
(3)CO+H2O
 HCO+OH-或C2O+H2O
HCO+OH-或C2O+H2O
 HC2O+OH- (4)0.3 mol Na2O2 0.1 mol Na2CO3
HC2O+OH- (4)0.3 mol Na2O2 0.1 mol Na2CO3
12.(2008年四川非延考区)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为________;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是________,写出该元素的任意3种含氧酸的化学式:__________________________________________________________
________________________________________________________________________;
(3)D和Y形成的化合物,其分子的空间构型为________;
(4)D和X形成的化合物,其化学键类型属__________,其晶体类型属__________;
(5)金属镁和E的单质在高温下反应得到的产物是________,此产物与水反应生成两种碱,该反应的化学方程式是____________________________________________________
________________________________________________________________________;
(6)试比较D和X的最高价氧化物熔点的高低并说明理由:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
[解析] 本题突破口在几种元素氢化物的构型,前20号元素中,氢化物构型为正四面体的为C、Si,三角锥形的为N、P,角形的为O、S,由原子序数依次增大得出D、E、X、Y、Z五种元素分别为C、N、Si、S、Cl。S的最高价为+6价,对应的氧化物为SO3;元素非金属性越强,最高价含氧酸酸性越强,所以能形成酸性最强的含氧酸的元素为Cl;CS2、CO2的空间构型均为直线形,C和Si形成以极性键构成的原子晶体。
[答案] (1)SO3
(2)Cl HClO、HClO2、HClO3、HClO4(任写3种酸)
(3)直线形 (4)共价键 原子晶体
(5)Mg3N2 Mg3N2+8H2O===3Mg(OH)2↓+2NH3·H2O[或Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑]
(6)D的最高价氧化物是CO2,X的最高价氧化物是SiO2,前者比后者的熔点低。因为前者为分子晶体,由分子间作用力结合,而后者为原子晶体,由共价键结合,共价键强度大于分子间作用力
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com