
题目列表(包括答案和解析)
2、钠和冷水反应 2Na+2H2O=2Na++2OH-+H2↑
1、碳酸钙与盐酸 CaCO3+2H+==Ca2++H2O+CO2↑
14.X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下三者之间可以两两发生反应生成物分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)X、Y、Z元素的原子序数之和为______________。若甲与Y单质在常温下混合就有明显现象,则甲的化学式为________________。丙在一定条件下转化为甲和乙的反应方程式为________________________________________________________________________。
(2)分析同主族元素性质的递变规律,发现乙、丙物质的沸点反常,这是因为它们的分子之间存在________。在乙、丙两种物质混合后的一种分散系中,滴入石蕊试液有明显的颜色发生变化,试用化学用语表示出该过程所涉及的化学原理________________________________________________________________________
________________________________________________________________________。
(3)①化合物丁含X、Y、Z三种元素,0.1 mol·L-1丁溶液的pH为1,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为________(选填序号)。
a.只含共价键
b.只含离子键
c.即含离子键,又含共价键
②在戊的水溶液中可能存在的各种离子的浓度大小关系为
________________________________________________________________________。
[解析] 常温下无色的气体单质只有H2、N2、O2,根据题中所述不难判断出X、Y、Z分别为H2、O2、N2。
[答案] (1)16 NO 4NH3+5O2高温催化剂4NO+6H2O
(2)氢键 NH3+H2O
 NH3·H2O
NH3·H2O
 NH+OH-
NH+OH-
(3)①c ②c(NO)>c(NH)>c(H+)>c(OH-)
13.A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可发生如下变化:A+B===C+D;B+E===2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
(1)写出A的电子式________;写出E的电子式____________________________。
(2)B的化学式为________;C的化学式为________;D的化学式为________;E的化学式为________。
(3)用电子式表示D的形成过程:___________________________________________。
[解析] 能与酸性氧化物、碱性氧化物反应的物质应为H2O。由5个原子核组成的粒子常见的有CH4、NH,根据给定的反应式可确定10电子的分子或离子NH+OH-===NH3↑+H2O OH-+H3O+===2H2O。
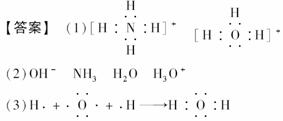
12.已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。试回答下列问题:
(1)写出五种元素的元素符号:
A________,B________,C________,D______,E________。
(2)写出下列物质的电子式:
①D元素形成的单质____________________________________________________;
②E与B形成的化合物__________________________________________________;
③A、B、E形成的化合物_______________________________________________;
④D与E形成的化合物_________________________________________________;
⑤D、C、E形成的离子化合物___________________________________________;
⑥A2B的电子式______________________________________________________。
[解析] 因为A、B离子的电子数相同,在电子总数为30的A2B离子化合物中,每个离子的电子数为10个,故可推知A是Na,B是O;因为由4个原子核、10个电子形成的分子中,每个原子平均不到3个电子,可知其中一定含有氢原子,分子中有4个原子核共10个电子,一定是NH3。因原子序数D>E,故D为N,E为H;C与A(Na)同周期,与B(O)同主族,所以C为S。
[答案] (1)Na O S N H
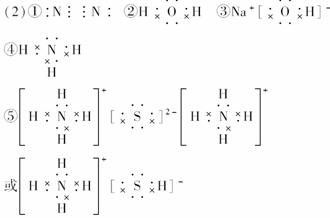
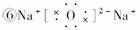
11.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是____________________________________。
(2)ZW2的电子式是______________,它在常温下呈液态,形成晶体时,属于________晶体。
(3)工业生产单质Y的原理是______________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是__________________________。
(5)0.1 mol的单质W与50 mL 1.5 mol·L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是________。
[解析] 根据题意先确定X是金属铍,进而可确定W是氯元素。再由X与W、Y与Z这两对原子的最外层电子数之和均为9以及四种元素原子序数大小关系可确定Y是铝元素,Z是硫元素。
[答案] (1)Cl<S<Al (2)∶···· ·××××× ·×···· ∶ 分子
(3)2Al2O3电解熔融4Al+3O2↑
(4)Be+2NaOH===Na2BeO2+H2↑ (5)3∶5
10.下列说法正确的是 ( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
[解析] A项,SiO2晶体是原子晶体,存在极性键。B项,稀有气体通过分子间作用力形成分子晶体。C项,干冰是分子晶体,升华时只破坏分子间作用力。D项,AlCl3是共价化合物。
[答案] B
9.下列说法正确的是 ( )
A.H与D,16O与18O互为同位素;HO、DO、HO、DO互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
[解析] 同素异形体指同种元素的不同单质,同系物指结构性质相似,组成上相差一个或若干个“CH2”原子团的有机物,所以A错误;SiO2晶体中每个Si原子和4个O原子形成4个Si-O键,每个O原子与2个Si原子形成共价键,所以B错误;HI的沸点低于HF是因为HF分子间有氢键存在,所以C错误;D中涉及的化合物应为Na2O2,所以答案选D。
[答案] D
8.根据相关化学原理,下列判断正确的是 ( )
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若A2+2D-―→2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性NaA<NaB
[解析] D项符合“越弱越水解”的规律。A项一般X>Y。B项氧化性A2>D2。C项原子序数M>R。
[答案] D
7.下列说法正确的是 ( )
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1∶1
D.H2S与SiF4分子中各原子最外层都满足8电子结构
[解析] 乙醇与水互溶,不能用乙醇做萃取剂;熔化NaCl克服离子键,熔化SiC克服共价键;24Mg、32S两种原子的质子数和中子数都相等;H2S分子中H原子最外层只有两个电子。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com