
题目列表(包括答案和解析)
5. 活性炭的作用是______________________________________________。
4. 常见的混凝剂有______________________________________________________,混凝剂的作用是_____________________________________________________,写出明矾溶于水后铝离子水解的离子方程式_____________________________________。
3. 居室空气中的污染物主要有___________________________________________。
2. 二氧化硫主要来源于_______________,它的危害是_______________,可以采用_______________方法治理;氮氧化物主要来源于_______________,它的危害是(1)_______________、(2)_______________、(3)_______________,可以采用_______________方法治理;可吸入颗粒的危害是______________________________,可以采用_______________方法治理。
1. 空气污染指数是根据_______________、_______________、_______________的浓度计算出来的,其中数值最大的叫做________污染物。
 石油的裂解已成为生产乙烯的主要方法
石油的裂解已成为生产乙烯的主要方法
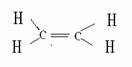
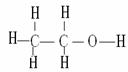 乙烯分子式:C2H4 结构简式:CH2==CH2 结构式
乙烯分子式:C2H4 结构简式:CH2==CH2 结构式
乙醇分子式:C2H6O 官能团-OH 结构简式:CH3CH2OH 结构式
乙酸分子式:C2H4O2,结构式:结构简式CH3COOH
 加成反应:CH2=CH2+H2O
加成反应:CH2=CH2+H2O CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br
CH3CH2OH CH2=CH2+Br2→CH2BrCH2Br
加聚反应
2CH3CH2OH
+ O2 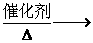 2CH3CHO
+ 2H2O
2CH3CHO
+ 2H2O
CH3CH2OH
+ CH3COOH 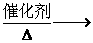
 CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
淀粉水解生成葡萄糖 检验葡萄糖(1)银镜反应 (2)与新制Cu(OH)2反应砖红色沉淀
油脂水解生成高级脂肪酸和甘油 蛋白质水解生成氨基酸
蛋白质 Na2SO4 、(NH4)2SO4 盐析 蛋白质 强酸 强碱 加热 重金属盐 乙醇 福尔马林 变性


化学反应速率:
影响化学反应速率的因素:
温度:温度越高反应速率越快)
压强:对于有气体参加的反应,增加压强化学反应速率越快
浓度:浓度越大反应速率越快
催化剂:使用正催化剂化学反应速率增大
放热反应:反应物的总能量>生成物的总能量 吸热反应:生成物的总能量>反应物的总能量
锌--铜原电池
负极: Zn-2e==Zn2+ 氧化反应 电子:负极→正极 电流:正极→负极
正极: 2H++2e=H2↑ 还原反应 (有气泡)
总反应:Zn+2H+==Zn2++H2↑ 溶液质量增加 PH增大
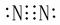
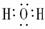
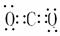 物质的电子式:N2
CO2
H2O
物质的电子式:N2
CO2
H2O
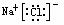
NaCl MgCl2
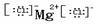 NaOH Na+
NaOH Na+
物质的形成过程:
(1)H Cl :  (2)NaCl:
(2)NaCl:
同周期,从左到右 元素的金属性逐渐减弱,元素的非金属性逐渐增强 原子半径减小
同主族,从上到下 元素的金属性逐渐增强,元素的非金属性逐渐减弱 原子半径增大
Na Mg Al Si P S Cl 金属性:Na>Mg>Al
金属性逐渐减弱 非金属性逐渐增强
非金属性:Cl>S>P>Si,
非金属性逐渐增强
非金属性:Cl>S>P>Si,
①元素的金属性越强,最高价氧化物对应的水化物(氢氧化物)碱性越 强,反之也如此。金属性:Na>Mg>Al,氢氧化物碱性强弱为NaOH > Mg(OH)2> Al(OH)3。
②元素的非金属性越强,最高价氧化物对应的水化物(含氧酸)酸性越 强 ,反之也如此。
非金属性:Si <P< S< Cl,H3PO4是 弱 酸,H2SO4是 强 酸, HClO4是最强酸;H3PO4 <H2SO4<HClO4 元素的非金属性越强,形成的氢化物越 稳定;氢化物的稳定性为SiH4<PH3<H2S<HCl
电解食盐水: 2NaCl + 2H2O == 2NaOH + H2↑ +Cl2↑ 铁与Cl2反应:2Fe+3Cl2===2FeCl3
Cl2 与 水:Cl2+H2O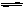 HCl+HClO
Cl2与NaOH:Cl2 +2NaOH=== NaCl+NaClO +H2O
HCl+HClO
Cl2与NaOH:Cl2 +2NaOH=== NaCl+NaClO +H2O
碘的提取: 2KI + C12 ==2KCl + I2 钠与水反应:2Na+2H2O=2NaOH+H2↑
碳酸钠与碳酸氢钠的性质比较
|
溶解性 |
易溶(同温下,溶解度大于碳酸氢钠) |
易溶 |
|
热稳定性 |
稳定 |
2NaHCO3△Na2CO3+CO2↑+H2O
|
|
碱性 |
碱性(相同浓度时,碳酸钠水溶液的PH比碳酸氢钠的大) |
碱性 |
|
盐酸 |
生成CO2 |
生成CO2 比碳酸钠与盐酸反应剧烈 |
碳酸钠与碳酸氢钠鉴别
固体:加热产生气体的是NaHCO3 溶液:加BaCl2产生沉淀的是Na2CO3
Al与强碱反应 2Al + 2 NaOH + 2H2O===2NaAlO2+3H2↑(唯一的一个)
氧化铝(Al2O3):溶于强碱Al2O3 + 2 NaOH = 2NaAlO2 + H2O
离子方程式 Al2O3 + 2OH-= 2AlO2-+ H2O 氢氧化铝和强碱反应 Al(OH)3 + NaOH = NaAlO2 + 2H2O
Fe3+检验:溶液中加入KSCN Fe3++3SCN一══Fe(SCN)3
Cl2与FeCl2反应:2FeCl2+Cl2==2FeCl3
FeCl3 与铁反应 : 2FeCl3 +Fe==3FeCl2
FeCl3 与铜反应:Cu+2FeCl3==CuCl2+2FeCl2
钢铁:电化学腐蚀,碳铁形成原电池
金属防腐的方法1.表面覆盖保护层, 2.改变内部结构; 3. 电化学保护法
SiO2与碱反应:SiO2+2NaOH==Na2SiO3+H2O 实验室装NaOH的试剂瓶用橡皮塞不用玻璃塞
二氧化硅的用途:SiO2是制造光导纤维的主要原料
硅酸盐工业:水泥的原料是黏土和石灰石 玻璃的原料是纯碱、石灰石和石英, (都有石灰石)
|
|
C与浓 H2SO4反应:C+2H2SO4(浓)====CO2↑+2SO2↑+2H2O
铵盐的性质:①易溶于水②与碱反应放出氨气③受热易分解④与碱反应放出氨气
HNO3强氧化性: Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
C + 4HNO3(浓) = CO2 + 4NO2 + 2H2O
钝化作用:常温下, 浓HNO3使Fe、Al钝化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com