
题目列表(包括答案和解析)
7.糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和 (写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是氨基(-NH2)和 (写结构简式或名称)。人体中共有二十多种氨基酸,其中人体自身___(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。写出葡萄糖在体内被氧化的化学方程式: 。
6.(1)下列食物中富含蛋白质的是 (填写编号)。
①苹果 ②葡萄干 ③牛奶 ④米饭 ⑤大豆
(2)我国政府从1994年起推出全民食用加碘盐工程,目前“加碘盐”主要是在食盐中加入碘酸钾,碘酸钾的化学式为 。
(3)葡萄糖能发生银镜反应说明其结构中含有官能团
(4)维生素C可以与酸性高锰酸钾溶液反应,高锰酸钾中的锰元素生成正二价锰离子,那么维生素C发生了 (氧化、还原)反应
5.化学对人体健康有着十分重要的作用。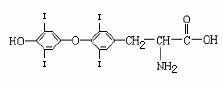 (1)为提高人体素质, 食盐加碘、食物补碘已引起人们的重视。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如右图:加碘食盐中碘的存在形式主要是__________(填序号);A.I
B.I2
C.KI
D.KIO3 甲状腺素的分子式为____________。
(1)为提高人体素质, 食盐加碘、食物补碘已引起人们的重视。据报道, 人从食物中摄取碘后碘便在甲状腺中积存下来, 通过一系列化学反应可形成甲状腺素。甲状腺素的结构如右图:加碘食盐中碘的存在形式主要是__________(填序号);A.I
B.I2
C.KI
D.KIO3 甲状腺素的分子式为____________。
(2) 某同学到了傍晚时就看不见东西,患了夜盲症,可能的原因之一是他体内缺乏________,另一同学在刷牙时牙龈经常出血,他可能缺乏____________,应多吃____________________。
4.大量的 和 扩散到大气中被雨水吸收,当雨水的pH小于 时就形成了酸雨。
某校科技小组的同学们采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
|
时间 |
开始 |
8h后 |
16h后 |
24h后 |
32h后 |
40h后 |
48h后 |
|
pH |
5.0 |
4.8 |
4.5 |
4.3 |
4.2 |
4.0 |
4.0 |
根据上述材料回答下列问题:
① 酸雨放置时,pH发生变化的主要原因为
② 下列物质中,最易被酸雨腐蚀的是( )
A、铜制塑像 B、大理石雕刻 C、水泥路面 D、塑料制窗框
3.为配合A市创建国家卫生城市活动,某校在综合实践活动中开展了相关研究。
(1)了解A市环境现状 查阅环境质量监测报告:A市降水的pH年均值约为5.07,说明A市空气中 含量超标。西郊饮用水源地水质为V类水质,主要超标项目为氮含量、粪大肠菌群。其水质污染的原因可能是 (任答一个原因)。
(2)寻觅丰富丝绸文化 A市以盛产蚕丝绸闻名,素有“丝绸之乡”之称。这里的“蚕丝”是指 。(填序号)
A.人造纤维 B.天然纤维 C.合成纤维
(3)参与建设生态城市 在社区调查中,居民提出了以下建议:①采取措施,减少和控制污染气体的排放;②禁止在水源河流放养鸭子,以免大量鸭粪污染河流;③植树造林,增大绿化面积;④就地焚烧垃圾,减少固体污染物。你认为合理的是 (填序号)
2.某生活污水有一股臭味,主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质。现欲将其经去渣、除臭处理后用作清洗厕所的用水,问:
⑴采用何种操作,可除去污水中的碎菜叶,碎塑料薄膜及泥沙?___________________
⑵用什么物质可除去污水中的臭味?___________________________________________
⑶把生活污水进行处理再利用的目的是什么?
⑷怎样检验⑴和⑵处理后的水中是否存在氯离子?_______________________________
1.保持洁净安全的生存环境已成为全人类的共识。
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。
(2)获得洁净安全的饮用水是每个人的正常需要。某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为
。
(3)人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是 _____。
6.一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:
2Fe3++Cu=2Fe2++Cu2+)。请按要求完成下列探究报告。
[探究目的]
从废液中回收铜,并重新得到FeCl3溶液。
[资料获悉]
①3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe3+:2.7~3.7 Cu2+:5.2~6.4 Fe3+:7.6~9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeCl3溶液。
[实验探究]
取几滴废液于试管中加水稀释后,滴加KSCN溶液出现血红色,可知废液中除含有Fe2+、Cu2+外,还含有Fe3+。
甲同学取10 mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称重得8.61 g ;乙同学另取10 mL废液,加入某试剂将pH调至4.0,使其中Fe3+转化为Fe(OH)3沉淀,而Fe2+、Cu2+仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32 g 。通过计算可知废液中c (Fe3+)= mol/L ,c (Fe2+)= mol/L ,c (Cu2+)= mol/L。
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeCl3溶液?
丙同学认为应该先向废液中加入w g铁粉[w = c (Cu2+)×1L ×56 g/mol],使之充分反应置
换出铜,过滤,得金属铜。再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达实验目的。有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
(1)
(2)
(3)
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的。(方案内容略)
[拓展延伸]
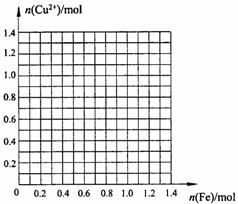
请画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用图像计算,当铜离子的物质的量减少一半时,加入铁粉的质量是 g 。
5.下面是某同学研究氯水漂白性的一个探究性实验片断。
活 动 记 录
[观察]氯气的颜色:黄绿色;氯水的颜色:呈黄绿色。
[结论]氯水中含有氯气。
[实验操作]用两根玻璃棒分别蘸取盐酸和氯水,各滴在两片蓝色石蕊试纸上。
[实验现象]滴有盐酸的试纸变红,滴有氯水的试纸上间变白,外圈变红。
[分析与结论]氯水呈黄绿色,说明氯水中溶有游离的氯气。滴有氯水的蓝色石蕊试纸外圈变红,说明氯水中有能使试纸变红的酸生成;中间变白,说明氯水中有能够使有色物质褪色的物质生成。
[问题与思考]氯气溶于水发生如下反应:Cl2+H2O=HCl+HClO,溶液中的水和盐酸都没有漂白作用,能够使有色物质褪色的物质是氯水中的氯气还是氯水中的次氯酸呢?还是二者都有漂白作用?
请你参照他已完成的部分实验活动记录,自己设计一个实验,证明到底是哪种物质有漂白作用。
[实验操作]
。
[可能的实验现象]
。
[分析与结论]
。
4.补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01mol/L、0.008mol/L等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
 ②样品处理
②样品处理
③准确量取一定体积的待测液于试官中(比色管),加入稍过量的KSCN溶液,并稀释到10mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
(1)配制100mL0.01mol/L[Fe(SCN)6]3-溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要: 、 。
(2)步骤②脱色过程包括:加入 (填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→ (填操作)。
(3)比色法确定待测液的浓度其原理是
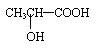 (4)若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学方程式:
(4)若其补铁剂是由乳酸(
)与铁粉作用生成的,请写出该反应的化学方程式:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com