
题目列表(包括答案和解析)
3.简答题:判断下列反应能否发生?若能,写出化学方程式。
(1)NaOH+HCl-
(2)AgNO3+HCl-
(3)K2CO3+HCl-
(4)NaCl+KNO3-
思路解析:酸、碱、盐之间的反应一般为复分解反应,判断反应能否发生,关键看该反应是否符合复分解反应发生的条件,看生成物中有没有沉淀、气体或水,反应物的可溶性是否符合要求。复分解反应对反应物可溶性的要求可以总结为酸碱、酸盐一般行,盐碱、盐盐都要溶。有的同学不太注意盐和碱、盐和盐发生复分解反应时对反应物要求全部是可溶的。
答案:(1)NaOH+HCl====NaCl+H2O
(2)AgNO3+HCl====AgCl↓+ HNO3
(3)K2CO3+2HCl====CO2↑+2KCl+ H2O
(4)NaCl+KNO3≠(不反应)
2.(2010山东嘉祥中考模拟)向一定量的Ba(OH)2溶液中逐滴加入稀H2SO4,与反应有关的变化关系用下图表示,其中错误的是( )
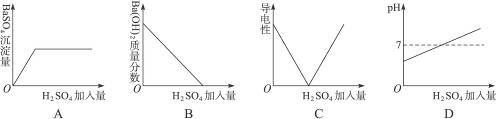
思路解析:Ba(OH)2溶液中滴加稀H2SO4后其pH应由高逐渐下降。
答案:D
1.下图中的四个图象分别代表对应的四种过程,其中正确的是( )
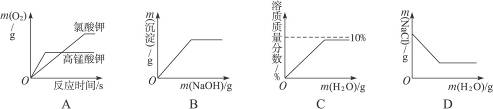
A.分别加热等质量的氯酸钾与高锰酸钾,反应过程中生成氧气的质量变化
B.向含有盐酸的氯化铜溶液中滴加过量烧碱溶液,产生沉淀的质量变化
C.向盛有10 g氧化钠固体的烧杯中加水配成100 g溶液,溶液中溶质的质量分数变化
D.将质量分数为20%的食盐水稀释至10%,稀释过程中溶质的质量变化
思路解析:B中不应是一开始就产生沉淀,而是NaOH全中和掉了稀HCl后才产生沉淀Cu(OH)2;C中w(NaOH)最后应为10%;D中W(NaCl)不变。
答案:A
6.下列各组物质中加入适量的稀盐酸,能够达到除掉杂质目的的是( )
A.NaOH中混有少量Na2CO3 B.Na2SO4中混有少量CaCO3
C.铜粉中混有少量铁屑 D.KNO3中混有少量KOH
思路解析:本题考查的是除杂问题,对于除杂问题,要遵循除杂不引入杂质的宗旨。A中引入了新的杂质氯化钠,B中引入了氯化钙,C中铜不和稀盐酸反应,而铁反应生成氯化亚铁,过滤就可以得到铜单质,D中引入了氯化钾。
答案:C
快乐时光
化石
地质系学生做野外实习,一个学生碰巧发现了一块大化石。讲师甲说这是一块树木化石,讲师乙坚持是一根恐龙腿骨。双方争论不已。学生们不知道是谁说得对,但是他们知道两位讲师都要给他们的实习报告评分,于是一个聪明的同学在报告上写,发现的是恐龙的木腿。
30分钟训练(巩固类训练,可用于课后)
5.下列说法中错误的是( )
A.一定温度下,NaCl的饱和溶液比它的不饱和溶液要浓
B.铜和氯化银反应生成银和氯化铜
C.浓硫酸不慎沾在皮肤上,立即用大量清水冲洗
D.酸跟碱作用而生成盐和水的反应叫中和反应
思路解析:氯化银不溶于水,不与铜反应;浓H2SO4滴在皮肤上,应先用布抹去,再用大量水冲洗,最后再涂上NaHCO3溶液。
答案:BC
4.将下列不同pH的各组溶液混合,得到溶液的pH可能为7的是( )
A.pH=3 pH=4 B.pH=11 pH=7 C.pH=6 pH=8 D.pH=0 pH=5
思路解析:pH为7的时候溶液呈中性。A中两个都是酸,则混合后也是酸,pH不可能为7;B中一个是碱性,一个是中性,混合后是碱性溶液,故也不可能是7;D中都是酸,同A。
答案:C
3.往稀盐酸中滴加氢氧化钠溶液至完全中和时为止,溶液的pH变化的图象正确的是( )
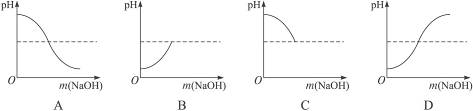
思路解析:酸的pH小于7,故开始的时候溶液的pH小于7,加入NaOH后,酸碱中和反应开始,溶液的酸性减小,则溶液的pH逐渐增大,当NaOH与HCl完全中和时呈中性,而中性溶液pH永远不会大于7。
答案:B
2.(2010山东邹城中考模拟)在实验室用15 mL氢氧化钠稀溶液和稀盐酸进行中和反应实验。完成下列问题:
(1)完成该实验必须使用的仪器是:___________。
(2)要判断氢氧化钠恰好被盐酸中和,需要加入___________试剂,观察到的现象是___________。
(3)要从中和后的溶液中获取氯化钠晶体,应进行的操作是:___________。
答案:(1)量筒、烧杯、玻璃棒、胶头滴管(或“量筒、锥形瓶、胶头滴管”)
(2)无色酚酞 溶液恰好由红色变为无色
(3)蒸发、结晶
1.做酸碱中和实验时,取一支试管,倒入2 mL氢氧化钠稀溶液,再滴入1-2滴酚酞试液,溶液呈红色。然后用___________逐渐滴入稀盐酸,同时不停地___________,直至溶液恰好变成___________色为止。此时试管内溶液的___________比滴加稀盐酸前一定___________。
答案:胶头滴管 振荡 无 pH 减小
3.人的胃液呈___________性。污水中的含酸量超标时,可以利用_________________进行中和处理。
答案:酸 熟石灰
10分钟训练(强化类训练,可用于课中)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com