
题目列表(包括答案和解析)
3、废金属可以通过回收加以利用。
随堂检学
2、人们通常采用在钢铁表面覆盖保护层的方法来防止钢铁生锈。例如:喷涂油漆、镀锡、镀锌、镀铬(克罗米)等。另外金属铝在空气中能“自我保护”。
1、铁在空气中锈蚀,实际上是铁跟氧气、水等物质互相作用,发生一系列复杂的化学反应,使铁转化为铁的化合物的过程。铁锈的主要成分是氧化铁。
了解:金属锈蚀的原理,尤其是铁制品锈蚀的原理及影响因素,并学会利用控制变量法探究金属生锈的条件。
知道:铁锈的主要成分(Fe2O3),除锈的方法以及防止金属锈蚀的一般方法。
知道:废旧金属对环境的污染,认识回收金属的重要性,提高资源意识和环保意识。
9.73克10%的盐酸与80克氢氧化钠溶液恰好完全反应。求NaOH溶液中溶质的质量分数和所得溶液中溶质的质量分数。
答案:解:设NaOH质量为x,生成NaCl的质量为y。
NaOH+HCl ==== NaCl+H2O
40 36.5 58.5
x 73 g×10% y
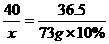 x=8 g
x=8 g
 y=11.7 g
y=11.7 g
w(NaOH)=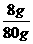 ×100%=10%
×100%=10%
w(NaCl)=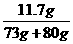 ×100%=7.6%
×100%=7.6%
答:NaOH溶液中溶质的质量分数为10%,所得溶液中溶质的质量分数为7.6%。
8.向40 g 10%的NaOH溶液中加入60 g 20%的NaOH溶液,混匀后取一半溶液,滴入2-3滴无色酚酞试液,然后逐渐滴加10%的稀盐酸,直到溶液的红色刚好褪去。
求:(1)混合后,所得NaOH溶液的质量分数。
(2)中和反应完毕后,所得溶液中溶质的质量分数。
答案:(1)混合溶液中NaOH的质量分数为:(40 g×10%+60 g×20%)/(40 g+60 g)×100%=16%
(2)设参加反应的盐酸溶液质量为x,生成NaCl的质量为y。
NaOH + HCl====NaCl+H2O
40 36.5 58.5
 ×16% 10%x y
×16% 10%x y
 x=73 g
x=73 g
 y=11.7 g
y=11.7 g
完全反应后溶液中溶质的质量分数为 ×100%≈9.51%(或9.5%)
×100%≈9.51%(或9.5%)
答:略
7.某海边化工厂利用海水中含有氯化镁,经过一系列的化学反应生产纯净的氯化镁,主要生产流程如图:

请写出(1)-(4)的操作或生产方法。
思路解析:本题的关键是如何从海水中把镁离子富集并提纯。富集需要生石灰,可以把海水中的镁离子变成沉淀,富集镁元素需要的生石灰,由煅烧石灰石获得。然后根据要求把所得到的氢氧化镁用盐酸溶解后结晶析出。
答案:(1)高温煅烧(2)加水(3)沉淀后富集(收集)(4)加盐酸溶解后结晶,制得无水氯化镁
6.日常生活中的下列做法,可用物质的化学性质解释的是( )
①用汽油洗掉衣服上的油污 ②用纯碱除去面团因发酵产生的酸味 ③用大理石作装饰材料④家族中熬骨汤时,加入少量食醋可以增加汤中的钙质。
A.①② B.②④ C.①③④ D.②③④
思路解析:①中油污可以溶解在汽油里,利用的溶解性是物理性质而不是化学性质;②利用纯碱可以和酸反应而减少酸味;③大理石耐磨实用,是其物理性质;④加入少量的食醋可以和骨头里面的钙盐结合生成溶于水的钙盐,从而减少钙的流失。
答案:B
5.写出由石灰石、碳酸钠和水作原料制备氢氧化钠的各步反应的化学方程式。
答案:
①CaCO3 CaO+CO2↑
CaO+CO2↑
②CaO + H2O====Ca(OH)2
③Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
4.写出下列转化的化学方程式:
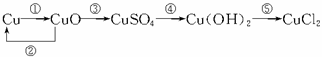
答案:①2Cu+O2 2CuO
2CuO
②CuO+H2 Cu+H2O
Cu+H2O
③CuO + H2SO4====CuSO4+ H2O
④CuSO4+ 2NaOH====Cu(OH)2↓+ Na2SO4
⑤Cu(OH)2+ 2HCl====CuCl2+ 2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com