
题目列表(包括答案和解析)
15.金刚石和石墨是由碳元素组成的两种不同的单质,它们物理性质不同、化学性质相同。
它们的物理性质差别大的原因碳原子的排列不同
14.生铁和钢:是混合物,都是铁的合金,
区别是含碳量不同,生铁的含碳量高,钢含碳量低。
合金:金属与金属(或非金属)熔合而成,具有金属性质的混合物。(纯净物不是合金)
13.铁的物理性质:有银白色金属光泽的固体,有良好的延性和展性,质软,是导体
铁的化学性质:(1)铁跟氧气反应 铁在潮湿的空气里(既有H2O又有O2时)易生锈,铁锈是混合物,主要成分是氧化铁Fe2O3
防锈方法:在铁表面涂一层保护膜(如涂漆或油);镀锌等金属或烤蓝
铁在氧气里燃烧生成四氧化三铁,剧烈燃烧,火星四射,生成黑色固体,放出热量
(2) 铁可跟酸(盐酸或硫酸)和排在铁后的金属的盐溶液发生置换反应(反应后溶液呈浅绿色)
① 铁跟硫酸铜溶液反应(现代湿法冶金的先驱)
化学方程式:Fe+CuSO4=Cu+FeSO4
现象:铁丝表面覆盖一层红色的铜, 溶液由蓝色变为浅绿色
②铁跟硫酸反应:Fe+H2 SO4=FeSO4 +H2 ↑
铁跟盐酸反应:Fe+2HCl=FeCl2 +H2 ↑
现象:有气泡生成,溶液由无色变为浅绿色
铁元素有三种氧化物:氧化铁Fe2O3 氧化亚铁FeO 四氧化三铁Fe3O4
12.生成氢气的反应(实验室制取H2最常用的试剂是:锌粒和稀硫酸,)
① 锌粒和稀硫酸反应 Zn + H2 SO4=ZnSO4+H2↑
② 铁和稀硫酸反应 Fe+H2 SO4=FeSO4 + H2 ↑
③ 镁和稀硫酸反应 Mg+H2 SO4=MgSO4+H2↑
④铝和稀硫酸反应 2Al+3H2 SO4=Al2(SO4)3+3H2↑
⑤锌粒和盐酸反应 Zn +2HCl=ZnCl2+ H2 ↑
⑥铁和盐酸反应 Fe+2HCl=FeCl2+H2↑
⑦镁和盐酸反应 Mg + 2HCl=MgCl2+H2↑
⑧铝和盐酸反应 2Al+6HCl=2AlCl3+3H2↑
11.氢气的性质(1)物理性质:密度最小的气体,难溶于水
(2)化学性质
①可燃性:氢气在空气中燃烧
2H2 + O2 2H2 O
2H2 O
现象:纯净的氢气在空气里安静地燃烧,发出淡蓝色火焰,放出热量
不纯的氢气点燃很可能会爆炸,所以点燃氢气前一定要先检验氢气的纯度。
②还原性:氢气还原氧化铜
H2 +CuO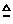 Cu+H2
O
Cu+H2
O
现象:黑色固体逐渐变为光亮的红色固体,管壁有水珠产生
氢气还原氧化铜实验注意事项:“酒精灯迟到早退”,即
开始时要先通入氢气后加热(目的是排净管内空气,防止氢气与管内空气混合受热发生爆炸);
实验结束时要先停止加热,继续通入氢气至试管冷却(防止生成的铜受热被氧化成CuO)现象?
(3)氢气的用途:充气球,冶炼金属,高能燃料,化工原料
10.工业制取氧气的方法:分离液态空气制取氧气,此变化是物理变化,不是分解反应
实验室制取氧气反应原理:
①加热高锰酸钾
2KMnO4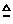 K2 MnO4 + MnO2 + O2 ↑
K2 MnO4 + MnO2 + O2 ↑
②加热氯酸钾和二氧化锰的混合物 2KClO3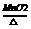 2KCl + 3O2 ↑
2KCl + 3O2 ↑
实验室制取氧气注意事项:
①试管口略向下倾斜(防止冷凝水倒流,使试管破裂);②用排水法收集氧气,导管口开始有气泡放出时不宜立即收集,当气泡连续地较均匀地放出后再收集(因为开始放出的气泡不纯,含有空气)③排水法收集氧气结束时,应先撤去导管,后停止加热(防止水倒吸入试管,导致热的试管破裂。)
其他生成氧气的反应:③水通电(正O2 负H2 ,体积比1:2)2H2 O==2H2 ↑ + O2 ↑
④加热氧化汞
2HgO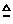 2Hg + O2 ↑
2Hg + O2 ↑
9.氧气的化学性质:支持燃烧,有助燃性。可供呼吸用,是常用的氧化剂。
⑴木炭在氧气中燃烧(O2可使带火星的木条的木条复燃)C + O2  CO2
CO2
现象:发出白光,放出热量,生成使石灰水变浑浊的气体
⑵硫在空气中燃烧,硫在氧气中燃烧 S
+ O2  SO2
SO2
硫在空气里燃烧发出微弱的淡蓝色火焰,产生有刺激性气味的气体,放出热量;
在氧气里燃烧发出蓝紫色火焰,产生有刺激性气味的气体;放出热量
⑶磷在空气中燃烧 4P
+ 5O2 2P2 O5
2P2 O5
现象:产生大量的白烟,放出热量
白磷着火点低,易自燃,要放在水中密封保存,可隔绝空气,防止它自燃。
⑷镁在空气(或氧气)中燃烧 2Mg + O2 2MgO
2MgO
现象:发出耀眼的白光,放出热量,生成白色固体
⑸铁丝在氧气中燃烧 3Fe
+ 2O2  Fe3 O4
Fe3 O4
现象:剧烈燃烧,火星四射,生成黑色固体,放出热量
此实验必须先在集气瓶里装少量水或在瓶底铺一层细砂,防止溅落的熔化物使瓶底炸裂
⑹氢气在空气中燃烧(点燃爆鸣气) 2H2
+ O2 2H2 O
2H2 O
现象:纯净的氢气在空气里安静地燃烧,发出淡蓝色火焰,放出热量;
不纯的氢气点燃很可能会发生爆炸;
可燃性气体或可燃性粉尘与空气混合,遇明火很可能会发生爆炸!
⑺蜡烛在氧气里燃烧得更旺,发出白光,放出热量,瓶壁内有水珠。
向瓶内倒入澄清的石灰水,石灰水变浑浊。
⑻ 加热碱式碳酸铜
(俗称铜绿)Cu2 (OH)2 CO3 2CuO + H2 O + CO2 ↑
2CuO + H2 O + CO2 ↑
(现象:绿色粉末变黑色,管壁有水珠,生成的气体使澄清的石灰水变浑浊)
8.氧气的用途:气焊、航天、潜水、登山、医疗、液氧炸药、炼铁、炼钢
7.氧气的物理性质:不易溶于水,密度比空气的略大。液氧、固态氧淡蓝色。工业上制取氧气的方法:分离液态空气-----物理变化。
6.测定空气成份或除去气体里的氧气,要用易燃的磷,磷燃烧后生成固体,占体积小易分离。 不能用碳、硫代替磷。碳、硫跟氧气反应生成气体,难跟其他气体分离。
( 三)氧气的性质和用途
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com