
题目列表(包括答案和解析)
1. 内涵分析法
利用化学概念中的关键性字词所反映的事物的本质进行解题的方法,叫内涵分析法。
考查概念一般是在选择题或填空题中出现,做好这一类题关键是对概念内涵和外延的理解,每一个概念都有其产生的原因和条件,抓住其形成过程,准确把握其中要点,对解决实际问题起重要作用。
[例1]下列基本反应类型中,一定有单质参与反应的是( )(2004年甘肃省中考题)
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
思路分析:本题实际考察对并列概念:化合、分解、置换、复分解反应物种类和类别的本质特征的理解。化合反应--反应物为两种或两种以上,可能有单质;分解反应--反应物为一种,且一定是化合物;置换反应--反应物为一种单质和一种化合物;复分解反应--反应物为两种化合物。于此可知:答案为C。
思维技巧:紧紧抓住四种基本反应类型的内涵进行解题。
[例2]在灭火过程中所采取的措施不正确的是( )(2004年北京市中考题)
A. 将燃烧着的可燃物与空气隔绝 B. 降低可燃物的着火点
C. 将未燃烧的可燃物与火源隔离 D. 使可燃物降温至着火点以下
思路分析:燃烧需要三个条件:一是要有可燃物,二是可燃物要与氧气接触,三是可燃物的温度要达到着火点。只要破坏其中一个条件,就能达到灭火的目的。很明显,A、C、D三个选项均可行,而B选项中“降低可燃物的着火点”不可行,一种物质的着火点一般情况下是不变的。答案:B
思维技巧:从燃烧的条件入手考虑灭火的措施。
[例3]下列有关物质的用途中,利用其物理性质的是( )(2004年辽宁大连中考题)
A. 氧气用于炼钢 B. 钢用于制导线
C. 氮气用作灯泡填充气 D. 镁用于制照明弹
思路分析:A选项是利用氧气能够支持燃烧的性质,属于化学性质;C选项是利用氮气的化学性质稳定,稳定性是物质的化学性质;D选项是利用镁燃烧时发出强的白光,也是根据它们的化学性质决定的用途。B选项用途是利用铁的导电性,而导电过程中无新物质生成,所以是由物理性质决定的用途。答案:B
思维技巧:物质的性质决定了物质的用途,而物质的用途又反映物质的性质。解题关键是分清物质的物理性质和化学性质。
5.催化剂、催化作用
(1)定义:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有变化的物质叫做催化剂(或叫触媒)。催化剂在化学反应中所起的作用叫催化作用。
(2)理解催化剂时要注意以下几点:
①“一变”:催化剂能改变其他物质的化学反应速率,“改变”既可以是加快,也可以是减慢。
②“两不变”:催化剂在化学反应前与化学反应后它的质量和化学性质都没有改变,这里没有涉及到化学反应之中。
③在加热氯酸钾制取氧气时,二氧化锰是催化剂,但不是说二氧化锰在任何反应中都是催化剂。
○技巧方法
4.化学反应类型
(1)基本反应类型
表1-3 基本反应类型
|
|
概念 |
简单表达式 |
举例 |
||
|
化合反应 |
两种或两种以上的物质 生成一种物质的反应 |
A+B=AB |
2Mg + O2  2MgO 2MgOCaO + H2O == Ca(OH)2 |
||
|
分解反应 |
一种物质生成两种或两 种以上其他物质的反应 |
AB=A+B |
CaCO3  CaO + CO2 ↑ CaO + CO2 ↑
 2H2 ↑+ O2
↑ 2H2 ↑+ O2
↑
|
||
|
置换反应 |
一种单质跟一种化合物 反应,生成另一种单质 和另一种化合物的反应 |
A+BC= B+AC |
H2SO4(稀)+ Zn═ ZnSO4 + H2↑ Fe + CuSO4 ═ FeSO4 + Cu |
||
|
复分解 反应 |
有两种化合物相互交换 成分,生成另外两种化 合物的反应 |
AB+CD= AD+CB |
HCl + NaOH == NaCl + H2O H2SO4+ CuO == CuSO4 + H2O |
在这四种基本反应类型中,置换反应和复分解反应较为复杂。
表1-4 置换反应的类型及发生的条件
 表1-5 复分解反应的类型及发生的条件
表1-5 复分解反应的类型及发生的条件
 (2)氧化反应和还原反应
(2)氧化反应和还原反应
从化学反应中反应物得氧或失氧的角度,可以把相应的化学反应分为氧化反应和还原反应。
①氧化反应:物质跟氧发生的化学反应叫做氧化反应。
②还原反应:含氧化合物里的氧被夺去的反应,叫做还原反应。
③氧化剂:供给氧,使别的物质发生氧化反应的物质。
④还原剂:夺取氧,使含氧化合物发生还原反应的物质。
例如:
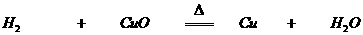
得氧 失氧
氧化反应 还原反应
被氧化 被还原
还原剂 氧化剂
一种物质被氧化,同时另一种物质被还原的反应叫做氧化还原反应。
注意:
a.反应中的“得氧”、“失氧”指的都是氧元素。
b.氧化反应和还原反应一定同时发生,在反应中有一种物质被氧化,必有另一种物质被还原。
c.氧化剂和还原剂都存在于反应物中。
⑤氧化反应与化合反应的区别:
化合反应从反应物与生成物种类上看,是“多变一”,而氧化反应则是反应物跟氧发生的反应。因此氧化反应不一定是化合反应,化合反应也不一定是氧化反应,它们之间没有必然联系。
如CH4+2O2 2H2O+CO2是氧化反应,但不属于化合反应;CaO + H2O == Ca(OH)2是化合反应,但不是氧化反应。
2H2O+CO2是氧化反应,但不属于化合反应;CaO + H2O == Ca(OH)2是化合反应,但不是氧化反应。
(3)吸热反应、放热反应
①吸热反应:指吸收热量的反应。
例如:C + CO2  2 CO
2 CO
②放热反应:指放出热量的反应。
例如:碳在氧气中燃烧放出大量的热。-
3.燃烧、爆炸、缓慢氧化、自燃
燃烧:可燃物跟空气里的氧气发生的发光发热的剧烈的氧化反应。
爆炸:某些可燃物在有限的空间里发生急剧的燃烧。
缓慢氧化:进行比较缓慢的氧化反应,不像燃烧那样剧烈地发光发热,如:动物呼吸、食物腐败等。
自燃:由于缓慢氧化而引起的自发燃烧,如白磷自燃。
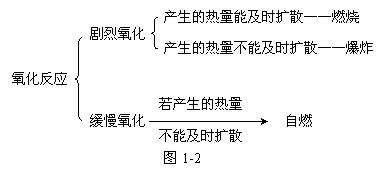 它们的本质特征:都是氧化反应,只是反应进行的剧烈程度不同。它们之间的关系如下:
它们的本质特征:都是氧化反应,只是反应进行的剧烈程度不同。它们之间的关系如下:
2.物理性质、化学性质
表1-2 物理性质与化学性质的比较
|
|
物理性质 |
化学性质 |
|
概念 |
物质不需要发生化学变化就能表现 出来的性质 |
物质在化学变化中表现出来的性质 |
|
实质 |
物质的分子组成结构不变,没有改 变所呈现的性质 |
物质的分子组成结构改变,所呈现的 性质也随之改变 |
|
性质 内容 |
颜色、状态、气味、熔点、沸点、 硬度、密度、溶解性、导电性、 导热性等 |
一般指物质与H2、O2、金属、非金属、 氧化物、酸、碱、盐等能否发生反应及 热稳定性 |
1.物理变化、化学变化
表1-1 物理变化与化学变化的区别和联系
|
|
物理变化 |
化学变化 |
|
概念 |
没有新物质生成的变化 |
变化时生成了新物质的变化 |
|
本质区别 |
宏观:没有新物质生成 微观:若是由分子构成物质, 分子不发生变化,只是分子间 的间隔、分子运动速度的大小 变了 |
宏观:有新物质生成 微观:分于本身发生了变化, 变成了新分子 |
|
外观特征 |
物质的状态、形状等发生了变化 |
常伴随发光、放热、变色、放出 气体、生成沉淀等 |
|
举例 |
水的三态变化、汽油挥发 |
镁条燃烧、碱式碳酸铜受热分解 |
|
区分依据 |
有没有新的物质生成 |
|
|
联系 |
在物理变化中,一般不会发生化学变化,但在化学变化中,一定同时 发生物理变化。 |
6.缓慢氧化与自燃的判断。
近几年各地中考,物质的物理变化和化学变化的判断,几乎是必考知识点。命题通常以“下列各种变化中,属于物理变化(或化学变化)的是 ”形式出现,题目中的“各种变化”,一般都是典型的物质变化实例,如冰雪融化、铁锅生锈等等。
有关物理性质和化学性质的概念题比较少见,相对较热的考点是物质的性质与用途关系的识别。试题多为给出了几种物质的用途,要求识别哪些用途是利用其物理性质(或化学性质)的选择题,或者是要求识别哪种物质具有此种用途的选择题。
四种基本反应类型及其应用是常考知识点,命题多为“给出化学方程式,要求判断反应类型”,或者是“给出几个反应物,按所要求的类型书写化学方程式”。
氧化剂、还原剂的判断是常考知识点,命题常以“在XX(新情景)反应中,还原剂(或氧化剂)是 ”形式出现。
燃烧的条件与灭火的原理也是相对较热的考点,命题多为跟燃烧与灭火有关的现实问题。
本专题通常以选择题、填空题、简答题形式考查,中考中所占分数约为4-10分。
●名师串讲
○知识图解
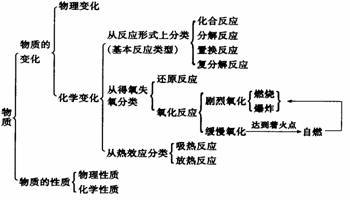
|
○重点讲解
5.燃烧及普通可燃物发生燃烧的条件以及灭火原理的应用;
4.氧化反应和还原反应分析与判断;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com