
题目列表(包括答案和解析)
9、几种物质的俗称
|
物质 |
化学式 |
俗称 |
物质 |
化学式 |
俗称 |
|
氯化钠 |
NaCl |
食盐 |
碳酸钠 |
Na2CO3 |
苏打、纯碱 |
|
氢氯酸 |
HCl |
盐酸 |
碳酸钠晶体 |
Na2CO3•10H2O |
纯碱晶体、石碱 |
|
氢氧化钠 |
NaOH |
火碱、烧碱、苛性钠 |
硫酸铜 |
CuSO4 |
无水硫酸铜 |
|
氢氧化钙 |
Ca(OH)2 |
固体:熟石灰、消石灰 溶液:石灰水 |
硫酸铜晶体 |
CuSO4•5H2O |
胆矾、蓝矾 |
8、化肥
①能够被植物所吸收的营养元素(比如:N、P、K等)主要是以化合态存在于盐中或者有机物中
②尿素是含氮量最高的氮肥
|
④碳铵的施用:不能在受热受潮下使用,原因是NH4HCO3→NH3↑+H2O+CO2↑(氮元素流失)
7、有关物质的酸碱性
一般而言,酸溶液是酸性的(pH<7);大多数的盐溶液是中性的(pH=7);碱溶液是碱性的(pH>7)。
[但是,在初中阶段学生还必须掌握①碳酸钠溶液②草木灰(主要成分是碳酸钾)的水溶液是碱性的(pH>7,能够使酚酞试液变红色,使紫色石蕊试液变蓝色)。]
6、物质的溶解性
①可溶性碱:氢氧化钾、氢氧化钙、氢氧化钠、氢氧化钡、▲氨水
②可溶性盐:钾盐、钠盐、铵盐、硝酸盐、硫酸盐(除硫酸钡)、盐酸盐(除氯化银)
(技巧:后三个正好对应的酸是三大强酸、前3个对应的碱也是溶于水的)
5、检验物质
|
被检验物质 |
选用的试剂 |
现象 |
有关的化学方程式 |
|
碳酸盐 |
①酸 |
气泡 |
例如:2HCl+ Na2CO3→2NaCl+ H2O +CO2↑ |
|
②氢氧化钙或氢氧化钡 |
白色沉淀 |
例如:Na2CO3+Ba(OH)2→BaCO3↓+2NaOH K2CO3+Ca(OH)2→CaCO3↓+2KOH |
|
|
③可溶性的钡盐或者钙盐 |
例如:Na2CO3+BaCl2→BaCO3↓+2NaCl Na2CO3+CaCl2→CaCO3↓+2NaCl |
||
|
硫酸盐 |
钡盐 (再滴加稀酸) |
白色沉淀 (不消失) |
例如:Na2SO4+BaCl2→BaSO4↓+2NaCl |
|
盐酸盐 |
硝酸银 (再滴加稀酸) |
白色沉淀 (不消失) |
例如:AgNO3+NaCl→NaNO3+AgCl↓ |
|
▲铵盐 |
可溶性碱 |
刺激性 气味 |
例如:NH4Cl+NaOH→NaCl+NH3↑+ H2O |
4、去除杂质(气体)
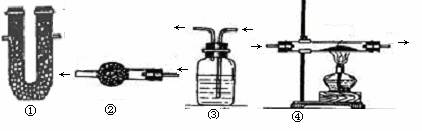
仪器名称:①U型管②干燥管③洗气瓶(“多功能瓶”)④硬质玻璃管
|
物质 |
选用试剂和装置 |
化学方程式 |
|
氧气 |
④中放铜粉或者用铜网 |
|
|
水蒸汽 |
①或者②中放固体氢氧化钠或碱石灰或者③中浓硫酸(最常用) |
|
|
氢气 |
④中放氧化铜 |
|
|
二氧化碳 |
①或者②中放固体氢氧化钠或碱石灰//③中氢氧化钠溶液 |
|
|
一氧化碳 |
④中放氧化铜 |
|
3、 检验气体
检验气体

仪器名称:①U型管②干燥管③洗气瓶(“多功能瓶”)④硬质玻璃管
|
物质 |
选用试剂和装置 |
化学方程式 |
|
水蒸汽 |
①或者②中放无水硫酸铜 |
|
|
氢气 |
④中放氧化铜+ ①或者②中放无水硫酸铜 |
|
|
二氧化碳 |
③中石灰水 |
|
|
一氧化碳 |
④中放氧化铜+③中石灰水 |
|
|
氯化氢气体 |
③中硝酸银溶液 |
|
2、物质在空气中长期露置,请判断可能发生的变化(变大、不变、变小)
|
物质 |
质量 |
▲溶液密度 |
变化 |
溶液浓度 |
原因 |
|
浓盐酸 |
变小 |
变小 |
物理变化 |
变小 |
盐酸具有挥发性,挥发出氯化氢气体 |
|
浓硫酸 |
变大 |
变小 |
变小 |
浓硫酸具有吸水性 |
|
|
氢氧化钠(固体) |
变大 |
/ |
化学变化 |
/ |
① 固体氢氧化钠能够潮解,所以其表面会“出汗” ② 固体氢氧化钠还会和空气中的二氧化碳反应 |
|
生石灰 |
变大 |
/ |
/ |
①生石灰会和空气中的水反应,生成熟石灰 ②熟石灰会继续和二氧化碳反应 |
|
|
石灰水 |
溶液质量变小 |
变小 |
变小 |
石灰水会和二氧化碳反应 |
|
|
石碱 |
变小 |
/ |
/ |
石碱会风化 |
|
|
无水硫酸铜 |
变大 |
/ |
/ |
无水硫酸铜会吸收空气中的水(颜色由白色变成蓝色) |
|
物质 |
俗称 |
物理性质 |
化学性质 |
||
|
固体颜色 |
溶液颜色 |
溶解性 |
|||
|
氯化钠NaCl |
食盐 |
白 |
无 |
可溶 |
①氯化钠可以和硝酸银反应 NaCl+AgNO3→AgCl↓+Na NO3 ②电解饱和氯化钠溶液可以得到氢氧化钠、氢气和氯气 |
|
碳酸钠 Na2CO3 |
苏打、纯碱 |
① 石碱会风化 ② 碳酸钠溶液是碱性的,pH>7 ③ 碳酸钠可以和酸反应 2HCl+ Na2CO3→2NaCl+ H2O +CO2↑ ④ 碳酸钠可以和石灰水(碱)反应 Na2CO3+Ca(OH)2→CaCO3↓+2NaOH ⑤ 碳酸钠可以和氯化钙(盐)反应 Na2CO3+CaCl2→CaCO3↓+2NaCl |
|||
|
碳酸钠晶体 Na2CO3•10H2O |
石碱、纯碱晶体 |
||||
|
硫酸铜 CuSO4 |
无水硫酸铜 |
蓝 |
① 无水硫酸铜检验水的存在 CuSO4+5H2O→CuSO4•5H2O (实验现象: ) ②
CuSO4•5H2O→CuSO4+5H2O (反应基本类型: ) ③ 硫酸铜和铁(活泼金属)反应 Fe+ CuSO4→Cu+ Fe SO4 (可用于去除硫酸亚铁中含有少量的硫酸铜) ④ 硫酸铜和碱反应 CuSO4+ Ba (OH)2→Ba SO4↓+Cu(OH)2 (此化学方程式可用于除去硫酸铜) CuSO4+2NaOH→Cu(OH)2↓+Na2 SO4 ⑤ 硫酸铜和氯化钡(盐)反应 CuSO4+BaCl2→Ba SO4↓+Cu Cl2 |
||
|
硫酸铜晶体 CuSO4•5H2O |
胆矾、蓝矾 |
蓝 |
[注意:氯化钠的溶解度受温度影响不大,因此要得到氯化钠晶体,可以采用蒸发结晶的方法;硝酸钾的等物质的溶解度受温度影响比较大,因此可以采取冷却热饱和溶液的方法]
▲ 知识整理
1、 物质的颜色
|
物质 |
颜色 |
物质 |
颜色 |
物质 |
颜色 |
|
硫酸铜溶液 |
蓝 |
氯化铜溶液 |
蓝 |
硝酸铜溶液 |
蓝 |
|
硫酸铁溶液 |
黄 |
氯化铁溶液 |
黄 |
硝酸铁溶液 |
黄 |
|
▲硫酸亚铁溶液 |
浅绿 |
氧化镁 |
白 |
四氧化三铁 |
黑 |
|
氧化铁 |
红 |
氧化铜 |
黑 |
二氧化锰 |
黑 |
|
氢氧化铁 |
红褐 |
氢氧化铜 |
蓝 |
氢氧化镁 |
白 |
|
硫酸铜粉末 |
白 |
硫磺 |
黄 |
红磷 |
红 |
2.其他
①物理性质
|
名称 |
颜色 |
潮解 |
▲导电性 |
密度 |
|
氢氧化钠 |
固体:白色 溶液:无色 |
固体:有 溶液:没有 |
导电 |
比水的密度大 |
|
氢氧化钙 |
无 |
|||
|
*氢氧化钾 |
[氢氧化钠能够潮解,所以可以作为许多气体干燥剂,但是它不能干燥酸性的气体,如:氯化氢、二氧化碳、二氧化硫、氯气等]
②用途
|
物质 |
用途 |
|
氢氧化钠 |
制皂、炼铝、造纸、精炼石油等 |
|
氢氧化钙 |
建筑、改良酸性土壤、配制波尔多液、制造漂粉精等 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com