
题目列表(包括答案和解析)
6.下列物质中,硬度最大的是 ( ) (A)石墨 (B)焦炭 (C)木炭 (D)金刚石
5.目前北京地区的空气污染指数是超标的,造成污染指数超标的主要原因之一是 ( ) (A)煤的燃烧,汽车排放的尾气 (B)氢气的燃烧 (C)植物的光合作用 (D)人的呼吸作用
4.98年春节期间,山西省朔州地区发生假酒中毒事件,这是因为假酒中含有过量(超标准)的 ( ) (A)乙醇 (B)醋酸 (C)甲醇 (D)碳酸
3.吸烟有害健康,原因之一是烟气中含有使血红蛋白不能很好地跟氧气结合的有毒气体,该气体是 ( ) (A)CO2 (B)CO (C)N2 (D)水蒸气
2.下列物质在纯氧中燃烧,能发出蓝紫色火焰的是 ( ) (A)镁带 (B)硫黄 (C)红磷 (D)铁丝
1.下列气体中,能使带火星的木条重新燃烧的是 ( ) (A)氧气 (B)氮气 (C)氢气 (D)二氧化碳
1.下列符号中,既能表示一种元素,又能表示该元素的一个原子,还能表示这种元素的单质的化学式的符号是
[ ]
A.C B.H
C.CO D.Fe
2.关于“2Al3+”的叙述正确的是 [ ]
A.两个铝离子,每个铝离子带3个单位正电荷
B.两个铝原子都是正三价
C.两个铝离子,带 6个单位正电荷
D.两个铝离子,带 3个单位正电荷
3.下列物质中含有相同原子团的一组物质是 [ ]
A.NaOH和Al(OH)3
B.Na2SO4和Na2SO3
C.KNO3和Cu(NO3)2
D.K2CO3和KClO3
4.由化学式难以确定的是 [ ]
A.分子的组成
B.各元素的质量比
C.式量
D.分子的体积
 A.两个钙离子
B.钙离子带两个单位的正电荷
C.钙离子的化合价是+2价
D.正二价的钙元素
6.下列物质的化学式书写错误的是 [ ]
A.AgNO3(硝酸银)
B.MgO2(氧化镁)
C.FeCl2(氯化亚铁)
D.Na2SO4(硫酸钠)
7.某氧化物中碳元素与氧元素的质量比为3:4,在此氧化物中关系正确的是
[ ]
A.碳与氧的原子个数比是1:1
B.碳与氧元素的质量比是1:1
C.碳与氧的原子个数比是1:2
D.氧的质量分数为57.14%
8.一个SO2分子和一个SO3分子中,含有一样多的是 [ ]
A.硫元素的个数
B.硫原子的个数
C.硫元素质量分数
D.氧元素的质量
9.某氮的氧化物中(NxOy),氮元素与氧元素的质量比为7:12,则化合物中x和y的值分别为
[ ]
A.7:12 B.8:7 C.2:3 D.7:8
10.用元素符号和相应的数字表示:
2个镁原子________;3个氯离子________;
一个氦分子________;2个氮分子________;
钠元素________; +1价的氢元素________;
2个氯化氢分子________;n个硫酸根离子________。
11.用氢、氧、碳、氯、铜五种元素中的元素,组成一种下列各类物质(用化学式表示):
含氧酸________;无氧酸________;
碱性氧化物________;碱________;
酸酐________;正盐________;碱式盐________。
12.已知一种碳原子(原子核内有6个质子和6个中子)的质量是1.993×10-26kg,另一种元素(R)原子的质量是mkg,则R元素的相对原子质量是________。
13.
硫酸铵[(NH4)2SO4]的式量为________,其中N:H:S:O=________。
14.98g硫酸(H2SO4)中含硫元素多少克?
15.某化合物5.2g在氧气中燃烧,生成17.6g二氧化碳和3.6g水,若此化合物的式量为26,试确定其化学式。
A.两个钙离子
B.钙离子带两个单位的正电荷
C.钙离子的化合价是+2价
D.正二价的钙元素
6.下列物质的化学式书写错误的是 [ ]
A.AgNO3(硝酸银)
B.MgO2(氧化镁)
C.FeCl2(氯化亚铁)
D.Na2SO4(硫酸钠)
7.某氧化物中碳元素与氧元素的质量比为3:4,在此氧化物中关系正确的是
[ ]
A.碳与氧的原子个数比是1:1
B.碳与氧元素的质量比是1:1
C.碳与氧的原子个数比是1:2
D.氧的质量分数为57.14%
8.一个SO2分子和一个SO3分子中,含有一样多的是 [ ]
A.硫元素的个数
B.硫原子的个数
C.硫元素质量分数
D.氧元素的质量
9.某氮的氧化物中(NxOy),氮元素与氧元素的质量比为7:12,则化合物中x和y的值分别为
[ ]
A.7:12 B.8:7 C.2:3 D.7:8
10.用元素符号和相应的数字表示:
2个镁原子________;3个氯离子________;
一个氦分子________;2个氮分子________;
钠元素________; +1价的氢元素________;
2个氯化氢分子________;n个硫酸根离子________。
11.用氢、氧、碳、氯、铜五种元素中的元素,组成一种下列各类物质(用化学式表示):
含氧酸________;无氧酸________;
碱性氧化物________;碱________;
酸酐________;正盐________;碱式盐________。
12.已知一种碳原子(原子核内有6个质子和6个中子)的质量是1.993×10-26kg,另一种元素(R)原子的质量是mkg,则R元素的相对原子质量是________。
13.
硫酸铵[(NH4)2SO4]的式量为________,其中N:H:S:O=________。
14.98g硫酸(H2SO4)中含硫元素多少克?
15.某化合物5.2g在氧气中燃烧,生成17.6g二氧化碳和3.6g水,若此化合物的式量为26,试确定其化学式。
元素及其化合物单元练习题
1.化学上把含碳的化合物叫做有机物,而一般把不含碳的化合物叫做无机物,但CO、CO2、CaCO3等虽然含有碳元素,因其组成和化学性质与无机物相似,故仍视其为无机物。
2.酸电离时有H+生成,但电离时有H+生成的化合物却不一定是酸。如:
KHSO4=K++SO42-+H+。
3.碱的溶液一般都显碱性,但显碱性的溶液不一定是碱的溶液,也可能是盐溶液如Na2CO3溶液,或者K2O、CaO的溶液。
4.盐一般是由金属离子和酸根离子组成,但铵盐却是由NH4+和酸根离子组成。
5.碱性氧化物一般都是金属氧化物,但金属氧化物却不一定都是碱性氧化物。如Mn2O7是酸性氧化物,ZnO是两性氧化物。
6.非金属氧化物一般是酸性氧化物,但CO、NO却属于不成盐氧化物。
7.式量相同的不一定是同一种物质。如:CO和N2的式量都近似为28,H2SO4和H3PO4的式量都近似为98。
8.化学式相同的不一定是同一种物质。如:金刚石(C)和石墨(C)。
9.构成相同的原子团不一定是同种原子团。如:KMnO4和K2MnO4中分别含有高锰酸根和锰酸根。
三、关于物质的性质和变化
1.在化学变化中一定同时发生物理变化,但在物理变化中不一定同时伴随有化学变化。
2.非金属一般是电的不良导体,但石墨的导电性能优良。
3.金属在常温下一般为固体,但Hg在常温下为液体。
4.酸一般是液体,但磷酸却是无色晶体。
5.固体物质的溶解度一般随温度升高而增大,但Ca(OH)2的溶解度却随温度升高而降低。
6.爆炸不一定都属于化学变化。如:锅炉的爆炸是物理变化。
7.一般情况下CO2既不燃烧也不支持燃烧,但K、Na、Mg却能在CO2中燃烧。
8.燃烧不一定都有O2参加。如:Na在Cl2中的燃烧。
9.在空气中不能燃烧的物质,在O2中不一定不能燃烧。如:Fe。
10.物质与O2的反应都是氧化反应,但氧化反应不一定都是物质与O2发生的反应。
11.同一物质的燃烧与缓慢氧化反应本质相同,但二者生成物不一定一致。如:Fe在O2中燃烧生成Fe3O4,而在空气中缓慢氧化却生成Fe2O3。
12.催化剂一般都能加快化学反应速率,但也有减慢化学反应速率的催化剂,如:在塑料、橡胶制品中加入“防老化剂”,就是为了尽量减慢其化学反应速率;催化剂一般都能改变化学反应速率,但能改变化学反应速率的不一定叫催化剂,如:KClO3中加入KMnO4制取氧气,KMnO4不能称为催化剂。
13.化学变化一般都有发光发热现象,但有发光发热现象的变化不一定都是化学变化。如:白炽灯通电后发光放热。
14.H2与O2的混合气体点燃不一定都会发生爆炸。如:混合气体中H2的体积分数低于或高于H2的爆炸极限时。(但点燃H2前一定要验纯)。
15.在金属活动性顺序表中排在前面的金属不一定都能把排在后面的金属从其盐溶液中置换出来。如:K、Ca、Na三种活泼金属。
16.盐和金属反应不一定都生成另一种盐和另一种金属。如:
2FeCl3+Cu=2FeCl2+CuCl2。
17.盐和酸反应不一定都生成新盐和新酸。如:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
18.盐和碱反应不一定都生成新盐和新碱。如:
Ba(HCO3)2+Ca(OH)2=CaCO3↓+BaCO3↓+2H2O。
19.两种盐反应不一定都生成两种新盐。如:
NaHSO4+NaCl Na2SO4+HCl↑。
20.两种盐起反应不一定都必须是可溶性盐。如:
CaSO4(微溶)+BaCl2=BaSO4↓+CaCl2。
21.酸和酸不一定不能反应。如:
H2SO4(浓)+H2S=S↓+SO2↑+2H2O。
22.酸性氧化物和酸不一定不能反应。如:
SO2+2H2S=3S↓+2H2O。
23.酸和碱不一定都能发生中和反应。如:
Ca(OH)2和H2CO3基本不反应。
四、其它
1.某物质5g完全溶于95g水中,所得溶液的溶质质量分数不一定是5%。如:物质CaO和CuSO4·5H2O。
2.若浓酸不慎洒到皮肤上一般马上用水冲洗,但浓硫酸沾到皮肤上应该先用布迅速拭去再用水冲净皮肤。
Na2SO4+HCl↑。
20.两种盐起反应不一定都必须是可溶性盐。如:
CaSO4(微溶)+BaCl2=BaSO4↓+CaCl2。
21.酸和酸不一定不能反应。如:
H2SO4(浓)+H2S=S↓+SO2↑+2H2O。
22.酸性氧化物和酸不一定不能反应。如:
SO2+2H2S=3S↓+2H2O。
23.酸和碱不一定都能发生中和反应。如:
Ca(OH)2和H2CO3基本不反应。
四、其它
1.某物质5g完全溶于95g水中,所得溶液的溶质质量分数不一定是5%。如:物质CaO和CuSO4·5H2O。
2.若浓酸不慎洒到皮肤上一般马上用水冲洗,但浓硫酸沾到皮肤上应该先用布迅速拭去再用水冲净皮肤。
[材料二] 什么叫物质的鉴别?
鉴别就是根据几种不同物质性质的不同及有关实验现象的不同,将它们一一区别开。
经常遇到的物质鉴别有气体鉴别;还有溶液的鉴别,也叫离子鉴别。
气体的鉴别是根据气体本身的特性来鉴别的。如用到氧气能支持燃烧的性质及能使带有余烬的木条重新复燃,或能使燃着的木条越着越旺的现象来鉴别氧气的;用氢气的可燃性、氢气燃烧时的火焰是淡蓝色的,氢气燃烧后的产物只有水这一种物质等特征来鉴别氢气;用一氧化碳的可燃性、一氧化碳燃烧时的火焰是蓝色的,一氧化碳燃烧后的产物是能使澄清石灰水变浑的二氧化碳这些特征来鉴别一氧化碳;用到二氧化碳不支持燃烧,能使燃着的木条熄灭,能使澄清石灰水变浑等特征来鉴别二氧化碳气体;用氮气不支持燃烧,能使燃着的木条熄灭,但不能使澄清石灰水变浑等特征来鉴别氮气。
酸、碱溶液鉴别则是根据酸、碱对指示剂显不同颜色来鉴别的。
Ag+、Cl-、SO42-、CO32-等离子的鉴别也是根据这些离子与某些试剂反应的不同现象来鉴别的。鉴别Cl-用到硝酸银和稀硝酸两种试剂。鉴别SO42-用到氯化钡(或硝酸钡)和稀硝酸两种试剂。鉴别CO32-用到强酸(如盐酸或硝酸)和石灰水两种试剂。鉴别Ag+用可溶性的盐酸盐溶液(或盐酸)和稀硝酸两种试剂。
在盐类鉴别时(如果是阴离子不同时)鉴别顺序一般是先鉴别碳酸盐,然后再鉴别硫酸盐、盐酸盐,当其它酸根阴离子都鉴别完以后,剩余的为硝酸盐。
[材料三] 如何检验H+、Ag+、OH-、Cl-、SO42-、CO32-六种离子?
(1)H+检验。
方法1将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变红,则证明H+存在。
方法2用干燥清洁的玻璃棒蘸取未知液滴在蓝色石蕊试纸上,如果蓝色试纸变红,则证明H+的存在。
方法3用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH小于7,则证明H+的存在。
(2)Ag+检验。
将少量盐酸或少量可溶性的盐酸盐溶液倒入盛有少量待测液的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失,则证明Ag+的存在。
(3)OH-的检验。
方法1将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变蓝,则证明OH-的存在。
方法2用干燥清洁的玻璃棒蘸取未知液滴在红色石蕊试纸上,如果红色石蕊试纸变蓝,则证明OH-的存在。
方法3将无色的酚酞试液滴入盛有少量待测液的试管中,振荡,如果酚酞试液变红,则证明OH-的存在。
方法4用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH大于7,则证明OH-的存在。
(4)Cl-的检验。
将少量的硝酸银溶液倒入盛有少量待测液的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失,则证明Cl-的存在。
(5)SO42-的检验。
将少量氯化钡溶液或硝酸钡溶液倒入盛有少量待测液的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失,则证明SO42-的存在。
(6)CO32-的检验。
将少量的盐酸或硝酸倒入盛有少量待测液的试管中,如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试管中,如果石灰水变浑,则证明原待测液中CO32-的存在。
[材料四] 计算反应后溶液里溶质的质量分数应注意的问题
例 在高温条件下,使30g碳酸钙完全分解,将产物氧化钙完全溶解在101.4mL的水中逐渐加入碳酸钠粉末,并不断搅拌,直到恰好无沉淀产生为止。求所得是何种溶液?溶液的溶质的质量分数是多少?(dH2O=1g/mL)
解:设消耗碳酸钠粉末质量为x,生成的氢氧化钠质量为y,二氧化碳质量为z,沉淀CaCO3的质量为w。
所完成的各步反应:
CaCO3 CaO+CO2↑
CaO+CO2↑
CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
知所得溶液是氢氧化钠溶液。
根据相关联的三个反应得到关系式:
CaCO3--Na2CO3--2NaOH--CO2--CaCO3
100 106 80 44 100
30g x y z w
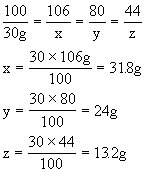
水的质量:WH2O=101.4mL×1g/mL=101.4g
求溶液的质量:根据质量守恒定律溶液的总质量应等于参加反应的各物质的质量总和加水的质量减去脱离出溶液的物质(二氧化碳气体和碳酸钙沉淀)的质量。
W溶液质量=30+31.8+101.4-30-13.2=120g
氢氧化钠溶液的溶质的质量分数为:
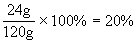
所得溶液是氢氧化钠溶液。
答:氢氢氧化钠溶液的溶质的质量分数为20%。
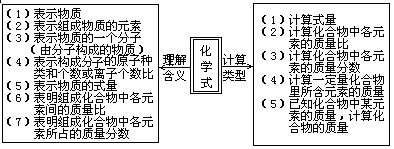
[材料五]有关化学式的计算
①计算物质的式量
②计算化合物中各元素的质量比
③计算化合物中某一元素的质量分数
④利用物质组成求元素的相对原子质量或物质的化学式
⑤利用化学式计算结晶水合物中结晶水的质量分数
⑥利用化学式求各元素的原子个数比
化学式含义与计算
[材料六]
金属跟酸反应生成氢气,有关三者之间质量关系专题分析
(1)质量相等的不同种金属跟足量的酸反应
由于酸是足量的,无论是盐酸或稀硫酸,金属都能跟它们起反应放出氢气,放出氢气的量,由金属的相对原子质量及化合价来决定。例如,在初中化学中跟酸反应常见的金属有钠、镁、铝、锌、铁。经计算,上述五种金属与足量酸反应,产生1g氢气所需金属的质量分别为:

[例]质量相同的钠、镁、铝、锌分别与足量的酸反应产生的氢气量从大到小顺序是[ ] A.Na>Mg>Al>Zn B.Zn>Al>Mg>Na C.Al>Zn>Na>Mg D.Al>Mg>Na>Zn
分析:从它们产生1g氢气所需金属分析Al为9g,Mg为12g,Na为23g,Zn为32.5g,如它们质量相同,如都为1g时,产生氢气的量就分别是9,12,23,32.5的倒数。
答:正确选项为D。
(2)过量的金属跟不足量的酸反应
它们的产生氢气的量由酸的量决定。如果是等量不同种酸,则酸的式量小的产生氢气大于式量大的酸。等量同种酸,产生氢气量相等。
[例]等量等溶质的质量分数的盐酸和硫酸,跟足量的锌反应,哪一种酸产生的氢气多?
答:盐酸产生的多。
[例]质量相等的镁、铝、锌、铁四种金属分别与足量的硫酸溶液反应,产生氢气的质量与四种金属质量的关系图像(见图),正确的是 [ ]
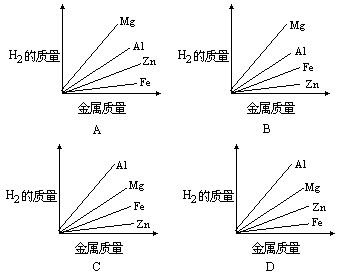
分析:四种金属与硫酸反应的化学方程式为:
Mg+H2SO4===MgSO4+H2↑
2Al+3H2SO4===Al2(SO4)3+3H2↑
Zn+H2SO4===ZnSO4+H2↑
Fe+H2SO4===FeSO4+H2↑
设参加反应的Mg、Al、Zn、Fe各为1g,根据规律可知:生成氢气的质量与金属的相对原子质量成反比,与该金属在生成物中的化合价

答:C
化学用语和化学量 练习题
47.由(NH4)2S、(NH4)2SO4、(NH4)2HPO4组成的混合物中,已知氮元素的质量分数为28%,则混合物中氧元素的质量分数是_______。
46.求CO(NH2)2中各元素的质量比____________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com