
题目列表(包括答案和解析)
1、发现室内煤气泄漏使人中毒时,应采取的措施是( )
A.就地做人工呼吸 B。立即关闭煤气阀门,打开门窗
C.就在拨打急救电话120,等医生来 D。立即打开换气扇开关
33.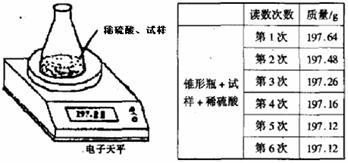 用右图装置测定因存放不当而部分变成碳酸钠的烧碱中氢氧化钠的质量分数。所取试样质量8.00 g、锥形瓶质量140.00 g,加入足量稀硫酸(质量为50.00 g)每隔相同时间读数一次,数据如下表:
用右图装置测定因存放不当而部分变成碳酸钠的烧碱中氢氧化钠的质量分数。所取试样质量8.00 g、锥形瓶质量140.00 g,加入足量稀硫酸(质量为50.00 g)每隔相同时间读数一次,数据如下表:
⑴不必进行第七次读数的原因是______ ____
_。
⑵计算试样中氢氧化钠的质量分数。
⑶所用稀硫酸中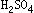 的质量分数不低于多少?
的质量分数不低于多少?
32.从三位科学家取得成功的事例中,你对科学的发明、发现或创造有什么认识?
。
31.复分解反应是我们学过的化学基本反应类型之一。
(1)下列化学反应中,属于复分解反应的是( )
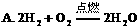
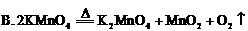
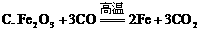
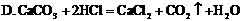
(2)科学家将复分解反应描述为“交换舞伴的舞蹈”,并表演了其含义。我们也可以用符号表达式来表示复分解反应,请补全下式:AB+CD→ 。
(3)你想过复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如反应BaCl2+Na2SO4=BaSO4↓+2NaCl中,实际参加反应的离子是Ba2+和SO42-,而Cl-、Na+则是“旁观者”,并没有参加反应。请你分析反应Ba(OH)2+2HNO3=Ba(NO3)2+2H2O中实际参加反应的离子是 。
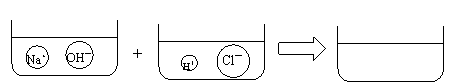
(4)请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图。
2005年10月5日,瑞典皇家科学院将本年度诺贝尔化学奖授予法国化学家伊夫·肖万、美国化学家罗伯特·格拉布和理查德·施罗克,以表彰他们在烯烃复分解反应研究领域作出的贡献。烯烃复分解反应是有机化学中最重要也是最有用的反应之一,烯烃复分解反应已被广泛应用在化学工业,尤其是制药业和塑料工业从中受益无穷。
早在1970年,法国化学家伊夫·肖万就已经详细地从理论上解释了烯烃复分解反应是如何进行的,并且列举了促进这种反应的催化剂的物质成分。1990年,肖万的理论第一次被理查德·施罗克应用在实践中并制造出效果优良的催化剂,两年后,罗伯特·格拉布又发展了施罗克的成果,制造出在空气中更稳定的催化剂。
在颁奖仪式上,评委会主席佩尔·阿尔伯格将烯烃复分解反应描述为“交换舞伴的舞蹈”。他亲自走出讲台,邀请身边的皇家科学院教授和两位女工作人员一起在会场中央为大家表演烯烃复分解反应的含义。最初两位男士是一对舞伴,两位女士是一对舞伴,在“加催化剂”的喊声中,他们交叉换位,转换为两对男女舞伴,在场记者随即发出了笑声。
30.催化剂在化工生产过程中有着重要作用,有的反应如果没有催化剂就不能进行,大多数化工生产都有催化剂的参与。CuSO4溶液对过氧化氢的分解具有催化作用。有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
(1)请你帮助他们完成实验报告:
|
实验过程 |
实验现象 |
实验结论 |
|
在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。 |
|
FeCl3溶液可以催化分解H2O2 |
(2)已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是:真正催化分解H2O2的是FeCl3溶液中的Cl-。
你认为最不可能的是 同学的猜想, 理由是 。
(3)同学们对余下的两个猜想,用实验进行了探究。请你仔细分析后填表:
|
实验过程 |
实验现象 |
结论 |
|
向盛有5ml5%的H2O2溶液的试管中加入少量 的HCl,并把带火星的木条伸入试管。 |
无明显现象 |
|
|
向盛有5ml5%的H2O2溶液的试管中加入少量 的 ,并把带火星的木条伸入试管。 |
|
|
29.(7分)全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时入放A、B、C三支试管中进行研究。
(1)请你帮助该学生完成下列实验设计的内容:
|
编号 |
操作方法 |
实验目的 |
|
A |
|
探究铁在干燥空气中的生锈情况 |
|
B |
放入铁钉,注入蒸馏水浸没铁钉,并用植物油液封 |
|
|
C |
|
探究铁在有空气和水时的生锈情况 |
(2)一周后,编号为________的试管中的铁钉最易生锈。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是______________________________________________________________。
(4)在焊接铁管时,为了使接口更加牢固,常用稀盐酸清洗接口处的铁锈,该反应的化学方程式为________________________________。
28.(7分)某课外活动小组为探究蜡烛的有关化学性质,已进行了查资料(内容略)、部分实验设计和观察及假设了部分结论,假如你是该组的成员,请你根据下表完成整个探究报告(填写在表中)。
|
实验操作及实验作图 |
实验现象 |
结论 |
A.将燃烧的蜡烛用烧杯将其罩住 |
|
|
B.将一根细木条按下图所示放入火焰中,约2秒后立即取出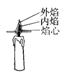 |
木条中间被烧痕迹最轻,越向两侧被烧痕迹越重 |
|
C.将涂有少量澄清石灰水的玻璃片放在火焰上方 |
|
|
|
D.假如蜡烛中含有氢元素,那么蜡烛燃烧的产物中有水生成.请依据此假设写出操作步骤(不作图): |
|
|
27. (7分)国家环保总局发布的《2004年中国
(7分)国家环保总局发布的《2004年中国
环境状况公报》中指出下列内容:a.酸雨污染呈加
重趋势 b.山西的临汾、阳泉、大同等三城市空气污染指数列全国113所环保城市前三位 c.七大水系中海河水系质量最差 d.我国城市人口占全国人口逾40%。由此根据所学知识回答:
(1)造成酸雨污染呈加重趋势的原因是(写一种) __________________________。
(2)山西污染指数中首位是可吸入颗粒物,这与所处地区自然资源与工业生产直接相关。你认为造成空气中可吸入颗粒物增多的原因是(写一种)_____________________。
(3)取海河水系某支流河水分析,其主要污染物有较多悬浮物,河水呈碱性,水中含较多CO32-离子和有机物质(淀粉、蛋白质、洗涤剂等),还有大量病原体(如细菌、寄生虫等)。
① 用pH试纸测定河水酸碱度的方法是________________________ _______
___________________________________________。
② 要除去水中的细小颗粒,可在水中加入___ ___(填物质名称)作净水剂,然后静置处理。
③ 要除去水体中较多的CO32-离子,并使水体呈中性,可加入的物质是(写一种)_____ __ 。
④ 水体中有机物增加,水体溶解氧的能力会___ ____(选填“增强”或“减弱”或“不变”)。
⑤为有效消除水体中的病原体,可选用下列物质中的__________(选填序号)。
A.二氧化碳 B.漂白粉 C.氧气 D.石子和细砂
26.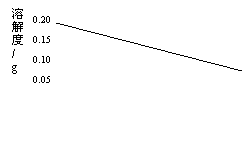 (3分)⑴右图是氢氧化钙的溶解度曲线,从图中你能得到的信息是(写出一条即可)。
(3分)⑴右图是氢氧化钙的溶解度曲线,从图中你能得到的信息是(写出一条即可)。
⑵若使20℃时不饱和的澄清石灰水变成饱和
溶液,可采取的措施是
、 。
25.(3分)大蒜被誉为“天然广谱抗菌素”.大蒜中的两种有效成分大蒜素和蒜氨酸的相关资料如下表所示:
|
成分 |
化学式 |
性 质 |
|
大蒜辣素 |
C6H10S2O |
无色油状液体,有臭味,难溶于水 |
|
蒜氨酸 |
C6H10NO3S |
无色针状晶体,无气味,易溶于水 |
(1)表格中提供的是两种成分的 (填“物理”或“化学”)性质。
(2)请从宏观和微观角度分析它们属于不同物质的原因。
宏观:_________________________________________________________________;
微观:_________________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com