
题目列表(包括答案和解析)
2.离子的形成。
(1)离子:因得失电子而带电荷的原子叫离子。如Na+、Cl-、OH-、SO42-等
(2)离子的分类。
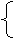 阳离子:带正电的离子
阳离子:带正电的离子
离子
阴离子:带负电的离子
写法:在元素符号的右上角标明电量和电性(电量为1的可省略不写)
如:Na+、Mg2+、Al3+;Cl-、S2-、O2-……
碳酸根离子: ,氢离子: ,2个亚铁离子: ,5个钙离子:
下列符号表示的意义:NO3-: ,7Fe3+ ,2H+
(3)离子符号及其意义(数字“2”的意义)。
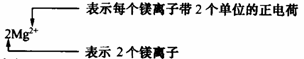
例如,指出下列符号中数字的意义:Fe2+
nCO2 , 3Cl-
5SO42-
(4)化合物的形成过程(以NaCl为例。)

1.核外电子的排布。
(1)核外电子的分层排布:元素的原子核外的电子层最少有1层,最多有7层;第一层不超过个 电子,第二层不超过 个电子,最外层不超过 个电子(只有1个电子层的最外层不超过2个电子)。
(2)原子结构简图各部分的意义:
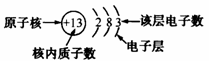
(3)相对稳定结构:最外层具有 电子(只有一个电子层的元素具有2个电子)的结构属于相对稳定结构。
(4)元素性质与元素最外层电子数的关系:
|
元素分类 |
最外层电子数 |
得失电子倾向 |
化学性质 |
|
稀有气体元素 |
8个(He为2个) |
不易得失、相对稳定 |
稳定 |
|
金属元素 |
一般 4个 |
易 最外层电子 |
不稳定 |
|
非金属元素 |
一般 个
|
易 电子 |
不稳定 |
(5)元素的性质,特别是元素的化学性质,是由 决定的。
3.元素周期表。
根据元素的原子结构和性质,把现在已知的一百多种元素按原子序数(核电荷数)科学有序的排列起来,这样得到的表叫元素周期表。
(1)元素周期表的结构:
①每-格:在元素周期表中,每一种元素均占据一格.对于每一格,均包括原子序数、元素符号、元素名称、相对原子质量等内容。此外在周期表中,还用不同的颜色对金属元素、非金属元素做了区分。
②每一横行(即: ):周期表每一横行叫做-个周期。共有 个横行,有 个周期。
③每-纵行(即 ):周期表的18个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一个族,共有16个族。
(2)元素周期表的意义:学习和研究化学的重要工具
①为寻找新元素提供了理论依据。
②由于在周期表中位置越靠近的元素性质越相似,可启发人们在元素周期表一定的区域寻找新物质所需的元素,(如农药、催化剂、半导体材料等。)
课题3 离子
2.元素符号。
国际上统一用来表示元素的一种特定的化学符号。
(1) 意义:①表示一种元素;②表示这种元素的一个原子。
例:N表示的意义有: 和 。
如果在元素符号前面添加系数,就只表示该元素的原子个数,不能表示该元素。如H既表示氢元素又能表示一个氧原子,而2H只能表示 ;3Fe表示 ;若要表示5个镁原子可记为: ,7个氯原子可记为: 。
元素与原子的比较
|
|
元素 |
原子 |
|
区别 |
是宏观概念,只表示种类,不表示个数 |
是微观概念,既表示种类,又表示个数 |
|
适用范围 |
表示物质的宏观组成,如水是由氢元素和氧元素组成的 |
表示物质的微观构成。如1个水分子是由2个氢原子和1个氧原子构成 |
|
联系 |
元素是核电荷数相同的一类原子的总称 |
原子是元素的最小粒子 |
(2)书写:①由一个字母表示的元素符号要大写;①由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。例如:钙 ,钠 ,钴 镁 ,铝 等。
(3)元素中文名称的特点:金属元素除“汞”以外都是“金”旁,例如:
非金属元素按单质在通常情况下的存在状态分别加“石”、“气”、“水”等偏旁,因此我们可以从它们的偏旁判断属于哪类元素。
1.元素。
元素是 的总称。
(1)元素种类:100余种(由此组成了3000多万种物质)
(2)地壳中含量前四位元素(质量分数):
(3)生物细胞中含量在前四位元素:
2.相对原子质量
⑴以一种碳原子(含有6个质子和6个中子的碳原子)的质量的1/12(约为1.66×10-27kg)作为标准,其他原子的质量跟它相比较所得的比值,就是这种原子的相对原子质量(符号为Ar)。
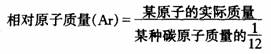
⑵相对原子质量是一个比值,在SI单位制中单位为“ ”(一般不写出)。原子的质量是原子的绝对质量,单位为克或千克。
⑶电子的质量很小,只相当于质子或中子质量的1/1836,所以原子的质量主要集中在原子核上。每个质子和中子的相对质量都约等于1,所以相对原子质量≈质子数+中子数。
课题2 元素
1.原子的组成
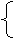 质子:每个质子带1个单位正电荷。
质子:每个质子带1个单位正电荷。
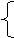
原子 中子:不带电
:每个电子带1个单位负电荷
⑴原子核所带电量数称为核电荷数,由于原子核所带电量和核外电子的电量相等,但电性相反,因此原子 电性。
核电荷数= =核外
⑵原子核内的质子数不一定等于中子数,普通的氢原子的原子核内无中子。
⑶原子的种类是由核 ( )决定的。
⑷原子核只占原子体积的很小一部分,原子内相对有一个很大的空间,电子在这个空间里作高速运动。
6.预防和消除水体污染的措施有:
(1)减少污染物的产生。
(2)对被污染的水进行处理使之符合排放标准。
(3)农业上提倡使用农家肥,合理使用化肥和农药。
(4)生活污水集中处理后再排放。
第四单元 物质构成的奥秘
课题1 原子的构成
5.爱护水资源的措施是一方面节约用水,提高水的利用率;另一方面要防止水体污染。
4.水体污染的主要来源:工业生产中废水未达标排放;农业上化肥、农药的不合理使用;生活污水的任意排放。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com