
题目列表(包括答案和解析)
1.质量守恒定律: 。这个规律就叫做质量守恒定律。
7.相对分子质量及其计算:
(1)相对分子质量:
(2)相对分子质量的计算:
例:CaCO3的相对分子质量=
CO(NH2)2的相对分子质量=
(3)计算物质组成元素的质量比:
例:H2O中各元素的质量比=
NH4NO3中N、H、O各元素的质量比=
(4)计算物质中某元素的质量分数:
例:NH4HCO3中氮的质量分数=
KClO3中氧的质量分数=
CuSO4﹒5H2O中氧的质量分数=
第五单元 化学方程式
课题1 质量守恒定律
6.化学式的读法:从右至左读作“某化某”。如CuO: , H2S
若含酸根的化合物,读作“某酸某”。如:CuSO4 ,KMnO4
(NH4)2CO3 , AgNO3
若含氢氧根的化合物,读作“氢氧化某”。如:NaOH
Ca(OH)2 ,Cu(OH)2
5.化学式的书写
(1)氧化物的化学式书写: 在右,例如,二氧化碳: ,氧化镁: ,
(2)一般化合物书写:金属元素的符号在 ,非金属元素的符号在 。
例如,氯化钠: ,氧化铁: ,硫酸铝: ,氯化锌
(3)用化合价原则书写:一般正价在 ,负价在 。
例如:氯化氢: ,氧化汞: ,碳酸镁: ,过氧化氢:
4.化合价与离子符号的书写有一定的区别:
|
化合价 |
离子 |
|
|
表示方法 |
用+1、+2、-1、-2……表示标在元素符号的正上方(“1”不省) |
用+、2+、-、2-……表示标在元素符号右上角(“1”省去) |
|
实例 |
+1 -1-1 +2 Na、Cl、OH、Ca |
Na+、Mg2+、Al3+、Cl-、SO42- |
|
联系与区别 |
同种元素(或原子团)的化合价和离子电荷通常在数值上相等,位置不同,正、负号的写法不同。 |
3.化合价。
化合物均有固定的组成,即形成化合物的元素有固定的原子个数比,化学上用“化合价”表示原子间相互化合的数目。
(1)化合价的一般规律:
①化合价有正价和负价。
a.氧元素通常显 价;
b.氢元素通常显 价;
c.金属元素跟非金属元素化合时,金属元素显 价,非金属元素显 价;
d.一些元素在不同的化合物中可显不同的化合价。
②在化合物里正、负化合价的代数和为 。
③元素的化合价是元素的原子在相互形成化合物时表现出来的一种性质,因此,在单质分子里,元素的化合价为 。
(2)常见元素及原子团的化合价:
|
+1价 |
K、Na、H、Ag、NH4 |
+2价 |
Ca、Mg、Ba、Zn、Cu |
|
-1价 |
F、Cl、I、OH、NO3 |
-2价 |
O、S、SO4、CO3 |
2.化学式的书写根据。
(1)因为物质的组成是通过实验测定的,因此化学式的书写必须依据实验结果。
(2)还可以应用元素的化合价来推求。
1.化学式。用元素符号表示物质组成的式子叫化学式。
(1)化学式的意义(以H2O为例):
|
分类 |
意义 |
实例 |
|
宏观 |
①表示一种物质 |
水 |
|
①表不该物质组成元素 |
水是由H、O两种元素组成的 |
|
|
微观 |
①表示物质的一个分子 |
一个水分子 |
|
②表示物质的分子构成 |
每个水分于是由2个氢原子和1个氧原子构成 |
如:
写出下列符号的意义:
3Fe ,5Al2O3 ,2H2 .
写出下列化学语的符号:4个钠离子: ,2个氯气分子: ,氮气 , 4个硫酸分子: ,氧元素: ,3个碳酸钠分子:
4.物质的构成与组成:
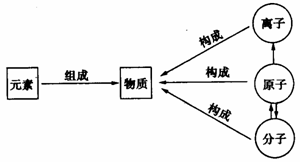
(1)纯净物是由同种或不同种 组成的。
(2)大多数纯净物是由分子构成的,如氧气、水……
(3)少数物质是由原子构成的,如铁、氖气等。
(4)还有少数物质是由离子构成的。如NaCl是由Na+和Cl-构成……
课题4 化学式与化合价
3.离子与原子的区别和联系:
|
粒子种类 |
原子 |
离子 |
||
|
阳离子 |
阴离子 |
|||
|
区别 |
粒子结构 |
质子数=核外电子数 |
质子数>核外电子数 |
质子数<核外电子数 |
|
粒子电性 |
不显电性 |
显正电性 |
显负电性 |
|
|
符号 |
用元素符号表示如Na、Cl |
用阳离子符号表示如Na+、Mg2+ |
用阴离子符号表示如Cl-、S2- |
|
|
联系 |
阳离子  原子 原子  阴离子 阴离子 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com