
题目列表(包括答案和解析)
5.(02扬州)把400g 20%的氯化钠溶液稀释成10%的溶液需加水 ( )
A.100g B.200g C.400g D.800g
4. (02山西)下列四个图象分别表示对应的四种操作过程,其中正确的是 ( )

A.加热氯酸钾制取氧气
B.向pH =2的盐酸中不断加水稀释
C.向pH =1的硫酸溶液中逐滴加入pH =13的KOH溶液
D.向10.4g 10%的BaCl2溶液中逐滴加入10%的Na2SO4溶液
3.(02山东)在化学反应A + 2B=C + 3 D中,2g A与4.1g B完全反应,生成5.6 g C。当有1.5g D生成时,参加反应的A的质量是( )
A.6g B.5.6g C.4.5g D.0.5g
2.(02黑龙江)在天平两端各放一个盛有200g 18.25%盐酸的小烧杯,调节天平平衡。分别向两烧杯中加入下列各组物质充分反应后天平仍保持平衡的是 ( )
A.18 g Mg、18 g Al B.20 g CaO、20 g CaCO3
C.10 g AgNO3、5 g Cu(OH)2 D.4 g Mg (OH)2、8.4 g MgCO3
1.(02南京)“神舟三号”宇宙飞船飞行成功,表明我国载人航天技术有了重大突破。运送“神舟三号”飞船的火箭所使用的燃料是偏二甲肼(化学式为C2H8N2)。下列说法正确的是(相对原子质量:H-1;C-12;N-14) ( )
A.偏二甲肼是由碳、氢、氮三种元素组成的
B.偏二甲肼中含有氮气
C.偏二甲肼的相对分子质量是27
D.偏二甲肼中碳、氢、氮三种元素的质量比为1:4:1
18. 将8 g硫粉分别在一定量的氧气中充分燃烧,实验如下:
|
|
第一次 |
第二次 |
第三次 |
|
氧气的质量/ g |
5 |
8 |
16 |
|
生成SO2的质量 / g |
10 |
16 |
16 |
(1) 这三次实验中,哪次符合质量守恒定律?为什么?
(2) 第一次为什么是生成10 g二氧化硫,而不是13 g二氧化硫?哪种物质有剩余?
(3) 第三次为什么是生成16 g二氧化硫,而不是24 g二氧化硫?哪种物质有剩余?
(4) 求二氧化硫中硫元素和氧元素的质量比。
答:(1) 表面看只有第二次符合质量守恒定律,实际上都符合。因为第一次是硫有剩余,第三次是氧有剩余。而质量守恒定律是指参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和,所以三次实验都符合。
(2) 第一次是因为有一部分硫没有参加反应,剩余物质是硫,为3 g。
(3) 第三次是因为有一部分氧气没有参加反应,剩余物质是氧气,为8 g。
(4) 由第二次可知,16 g二氧化硫中含有8 g硫元素和8 g氧元素,所以硫元素与氧元素的质量比为1∶1。
链接中考:
17.一块表面被氧化成三价金属氧化物的金属样品A,据测定该氧化物中金属元素与氧元素的质量比为9∶8。取样品A 12.9 g放入300 g稀盐酸中,待样品A完全溶解后,收集到0.3 g氢气;在反应后的溶液中,加入10%的氢氧化钠溶液40 g,恰好将溶液中剩余的盐酸中和。求:
(1) 该金属的相对分子质量;
(2) 样品A中此金属元素的质量分数;
(3) 所用盐酸中溶质的质量分数。
16.某元素有可变化合价,该元素在价态为a的氧化物中的质量分数为50%,在价态为a+2的氧化物中的质量分数为40%,求该元素的相对原子质量。
15.某Na2S、Na2SO3、Na2SO4的混合物中,S的质量分数为32%,则此混合物中Na与S的质量比为 ,O质量分数为 。
14.i℃时,把a
g NaCl固体投入到b g水中( i℃时,NaCl的溶解度为c g),该NaCl溶液中,当NaCl的质量分数既可以用 ×100%计算,也可以用
×100%计算,也可以用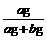 计算,则该NaCl溶液是
溶液。(填“饱和”或“不饱和”)
计算,则该NaCl溶液是
溶液。(填“饱和”或“不饱和”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com