
题目列表(包括答案和解析)
4、差量法
例3.把22.4g铁片投入到500gCuSO4溶液中,充分反应后取出铁片,洗涤、干燥后称其质量为22.8g,计算
(1)析出多少克铜?
(2)反应后溶液的质量分数多大?
解析:“充分反应”是指CuSO4中Cu2+完全反应,反应后的溶液为FeSO4溶液。
分析下面的化学方程式可知:每溶解56gFe,就析出64g铜,使铁片质量增加8g(64-56=8),反过来看:若铁片质量增加8g,就意味着溶解56gFe、生成64gCu,即“差量” 8与方程式中各物质的质量(也可是物质的量)成正比。所以就可以根据题中所给的已知“差量”22.8-22.4=0.4g 求出其他有关物质的量。
3.极值法
例4.取5.4 g由某碱金属R及其氧化物R2O组成的混合物。该混合物与足量的水反应。反应完毕,蒸发反应后得到的溶液,得到8 g无水晶体。试通过计算,判断该金属是哪一种碱金属?
解析:(i) 设5.4克混合物都是碱金属R,则由
 (ii) 设5.4 g 混合物都是碱金属R的氧化物R2O,则由
(ii) 设5.4 g 混合物都是碱金属R的氧化物R2O,则由

综(i)和(ii)所述,碱金属R的式量k的范围为(10.7,35.3)。在碱金属中,只有金属Na的式量23在(10.7,35.3)中,所以该碱金属是金属钠。
2.十字交叉法
例2.用向下排气法在容积为V mL的集气瓶中收集氨气,由于空气尚未排净,最后瓶内气体的平均式量为19,将此盛满气体的集气瓶倒置于水中,瓶内水马上升到一定高度后,即停止上升,则在同温同压下,瓶内剩余气体的体积为
( )
A. V/4 mL B. V/5 mL C.V/6 mL. D. 无法判断
解析:用十字交叉法计算氨气与空气的体积比:
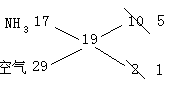
所以氨气占5/6,空气占1/6;由于氨气易溶于水,故剩余气体为空气。
2.平均值法
例1.锌、铁、镁三种金属中的两种混合物13 g,与足量的盐酸反应产生的氢气在标准状况下为1g,则混合物中一定含有的金属是 。
(A)锌 (B)铁 (C)镁 (D)无法推断
解析:根据锌、铁、镁三种金属与足量的盐酸反应,均生成二价金属阳离子得:(R为金属,设平均式量M)
R + 2HCl= RCl2+ H2
M 2g
13 1g
M:13=2:1
M=26
则必须有相对原子质量大于26和小于26的金属存在,又因为锌、铁的相对原子质量均大于26,只有镁的相对原子质量小于26,故答案为C。
1.守恒法:
例1、由Mg(OH)2和MgO组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为 ( )
A.12% B.24% C.20% D.30%
解析:根据在化学反应中Mg元素的质量守恒,建立Mg元素和MgSO4 的质量关系可求得反应后所得溶液中的溶质MgSO4的质量,即可求得所得溶液中溶质的质量分数。
Mg - MgSO4
24 120
10g×48%
=4.8g x
2.化学计算的常用技巧
(1)定量问题定性化;(2)近似估算;(3)运用整体思维,化繁为简;(4)利用图象
解题等等。
1.化学计算的常用方法
(1)守恒法:包括原子个数守恒、得失电子守恒、电荷守恒法、质量守恒法等。
(2)极值法: 从问题的极端去思考、去推理、判断,使问题得到解决。
(3)讨论法:当题中含有不确定的因素时,对每一种可能情况进行的讨论。
(4)十字交叉法:已知混合中某一量的平均值,求混合物中两物质的质量比。
(5)差量法:运用前后量的差,根据方程式中的计量数的关系直接求解。
10、校进行化学实验考查时,教师给了同学们1小包黑色粉末,这种黑色粉末可能是氧化铜、炭粉或者是这两者的混合物,让他们通过实验探究来确定。某同学探究过程如下:
(1)[提出假设]假设1:黑色粉末是炭粉;
假设2:
假设3.
(2)[设计实验方案]他对实验做了如下设想和分析:取少量黑色粉末于烧杯中,并加入过量的稀硫酸。则实验中可能出现的现象与对应结论如下表,请你完成下表。
|
实验中可能出现的现象 |
结论 |
|
① |
假设1成立 |
|
② |
假设2成立 |
|
③ |
假设3成立 |
(3)[进行实验]通过实验及分析,确定该黑色物质为炭粉和氧化铜的混合物。
(4)[拓展]为了进一步探究炭粉和氧化铜的性质,他又利用这种混合物补充做了如下实验:将此黑色粉末隔绝空气加热(若碳完全反应),待冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,反应完全后,静置。请你回答:
①烧杯中 (填“有”或“无)不溶物;
②若静置后溶液呈无色,则该溶液中溶质是 (写作学式);
③若静置后溶液呈蓝色,该反应的化学方程式为:
9、X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验。
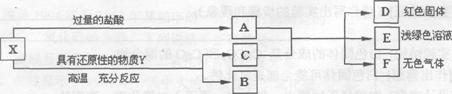
(1)x中含有的金属元素是 ______(填元素符号)。
(2)写出X中一种成分与盐酸反应的化学方程式:_________。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。
8、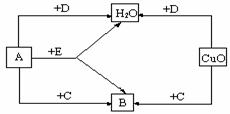 A、B、C、D、E是初中化学中常见的5种无色气体,其中2种是单质,3种是化合物。它们之间的转化关系如下图所示。
A、B、C、D、E是初中化学中常见的5种无色气体,其中2种是单质,3种是化合物。它们之间的转化关系如下图所示。
请写出你的推断结果:
A ,B ,C ,D ,E 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com