
题目列表(包括答案和解析)
3.化合价
⑴ 化合价 元素的原子相互化合的数目,就是这种元素的化合价。
⑵ 化合价的实质: 元素的一个原子在与其他元素原子化合时得失电子的数目或共用电子对的数目。
⑶ 化合价的规律:
① 在化合物中,元素正负化合价的代数和为零。(原子团中,元素正负化合价代数和等于原子团的化合价)
② 在化合物中,通常是:H、O。
③ 金属元素通常显______价,非金属元素通常显_____价(但在非金属氧化物中,氧显负价,另一种非金属显正价)。
④ 单质中,元素的化合价为零。因为元素的化合价是元素的原子在形成化合物时表现出来的性质。
⑤ 可变化合价:在不同条件下,同一种元素可以呈现不同的化合价。但,元素在某一具体化合物中的化合价则是固定的
[思考]
①某一元素的离子符号与化合价在表示方法、意义上有什么不同?又有什么联系?举例说明。
②同一化合物里同种元素的化合价一定相同吗?
⑷ 熟记常见元素的化合价
+1,钾,钠,氢和银;+2钙,镁,钡和锌;-1,氟,氯,-2氧;-3、+5是磷,氮;
2.元素的性质与原子结构关系
|
元素的分类 |
最外层电子数 |
稳定性 |
化学性质 |
|
稀有气体元素 |
一般是8个(氦为2个) |
稳定 |
相对稳定不易得失电子 |
|
金属元素 |
较少(一般少于4个) |
不稳定 |
易失最外层电子 |
|
非金属元素 |
较多(一般4-7个) |
不稳定 |
易得电子 |
①元素的性质,特别是化学性质主要由元素原子的______________决定;
②元素的分类由元素原子的_______________决定;
③元素的种类由元素原子的_______________决定;
④决定元素化合价的粒子是原子的最外层电子数;
⑤决定原子质量的大小主要是原子核内质子与中子的质量。
1.核外电子排布----分层排布,原子结构示意图
 [例题]下面是几种粒子的结构示意图:
[例题]下面是几种粒子的结构示意图:
①A-E共有四种元素;②表示原子的粒子是B、C、D;③表示阴离子的粒子是A;④表示阳离子的粒子是E;⑤表示相对稳定结构的粒子是A、C、E;⑥在化学反应中易失去电子的粒子是B。
6.相对原子质量与相对分子质量
① 以一种碳原子的质量的1/12(约1.66×10-27kg)作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。
②化学式中各原子的相对原子质量的总和就是相对分子质量。
[思考]⑴ 根据二氧化碳和一氧化碳的化学式计算:
① 二氧化碳和一氧化碳的相对分子质量;②二氧化碳里碳元素和氧元素的质量比;③二氧化碳里各元素的质量分数;④11g 二氧化碳里含碳多少g ;⑤多少g 二氧化碳里含有6g 碳;⑥含碳元素质量相等的二氧化碳和一氧化碳的质量比是多少;⑦质量相等的二氧化碳和一氧化碳里含氧元素质量比是多少。
⑵ 已知某氮的氧化物中,氮元素与氧元素的质量比为7∶20,试求此氧化物的化学式。
第六课时 水 氢气
⒈ 水
⑴ 水的污染 工业生产中的废渣、废水、废气和生活污水的任意排放,农业生产中施用的农药、化肥随雨水流入江河中,都会使水受到污染。
⑵ 水污染的防治 ①加强对水质的监测;②对工业“三废”进行综合利用、处理后再排放;③农业上要合理使用农药和化肥。
⑶ 水的净化 天然水中含有许多可溶性和不可溶性杂质,常呈浑浊状态。经过沉淀、过滤、吸附等净化处理,浑浊的水会变成澄清,即除去了水中的不溶性杂质。
⑷ 电解水 ①化学方程式为:______________________;负极产生______,正极产生_______;其体积比为_________;质量比为__________。
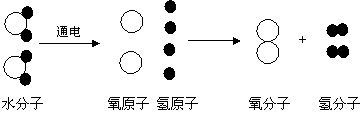 [例题]下图是电解水时水分子分解过程示意图。水分解的过程反映了哪些有关物质结构和变化的规律或结论?(至少写出四条)
[例题]下图是电解水时水分子分解过程示意图。水分解的过程反映了哪些有关物质结构和变化的规律或结论?(至少写出四条)
[解答]①在化学反应中,分子可以分解成原子,原子又重新组合成分子。②1个水分子是由2个氢原子和1个氧原子构成的。③原子是化学变化中的最小粒子。④水是由氢氧元素组成的。⑤在化学反应中,元素的种类不变。⑥参加化学反应的各物质的质量总和等于反应后生成的各物质质量总和。
[练习]许多化学反应都能生成水。请按照以下反应类型,各写一个生成水的化学方程式:
化合反应_________________;分解反应________________________;
置换反应_________________;复分解反应______________________;
⒉ 氢气
⑴ 氢气的化学性质
①可燃性:(--高能燃料)
A.纯净的氢气在空气里安静地燃烧,产生淡蓝色火焰,放出热量。
B.不纯氢气点燃可能发生爆炸。因此点燃氢气前一定要检验氢气的纯度。
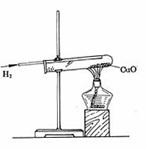 2H2 + O2
2H2 + O2 2H2O
2H2O
[思考]如何检验氢气的纯度?
② 还原性:(--冶炼金属)
CuO +
H2  Cu + H2O
Cu + H2O
A.现象:黑色的氧化铜变红色,试管口有水珠产生。
B.步骤:氢-灯-灯-氢;先通氢气防爆炸,后撤氢气防氧化。
C.注意:① 试管口略向下倾斜。目的是防止生成的水倒流到热试管底部而引起试管炸裂。②通氢气的导管应通到试管的底部,在氧化铜的上方。目的是利于试管内的空气排尽,使氢气与氧化铜充分接触。
⑵ 氢气的用途:性质决定用途
①氢气密度小--充气球、飞艇;
②还原性--冶炼金属、制高纯硅等;
③可燃性--做燃料、高能燃料、发射火箭、氢氧焰切割或焊接金属等。
⑶ 氢气的实验室制法
① 原料:锌(Zn)和稀硫酸或稀盐酸(不能用浓硫酸或浓硝酸,因浓硫酸亚铁或浓硝酸有强氧化性;也不要用浓盐酸,因浓盐酸具有挥发性,否则,制得的氢气不纯。)
② 反应原理(化学方程式):Zn + H2SO4 = ZnSO4 + H2↑
③ 实验现象:锌粒表面有气泡。
④ 实验步骤:a 检查装置的气密性 b装入锌粒 c 加入稀硫酸 d 验纯 e 收集气体。
⑤ 收集方法:a 排水法(因为氢气难溶于水)b向下排空气法(因为氢气密度比空气小)
[思考1]实验室制氧气和氢气的发生装置是否相同?为什么?
[思考2]气体收集方法的确定,取决于气体的哪些性质?
[思考3]工业上是如何制取氢气的?
[例题]若3g 不纯的锌(含杂质金属M)和3g 不纯的铁(含杂质金属N),分别与足量的稀硫酸充分反应后,都得到0.1g 氢气,则M、N可能是( )
A.M为Fe、N为Mg B.M为Al、N为Ag C.M为Mg、N为Zn D. M为Cu、N为Al
第七课时 核外电子排布 元素的化合价
5.氧化反应与还原反应
⑴ 物质跟______发生的化学反应。 ⑵ 含氧化合物中的______被夺去的反应。
[例题]在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:
2Na + Cl2 == 2NaCl 反应前后,Na ,Cl 的化合价发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号) A C E 。
A.2Mg
+ O2  2MgO
B. CaO + H2O ==Ca(OH)2 C.2KClO3
2MgO
B. CaO + H2O ==Ca(OH)2 C.2KClO3 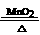 2KCl
+ 3O2↑
2KCl
+ 3O2↑
D.CaCO3
 CaO
+ CO2 E.H2
+ CuO
CaO
+ CO2 E.H2
+ CuO 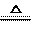 Cu
+ H2O
F.HCl + NaOH ==NaCl + H2O
Cu
+ H2O
F.HCl + NaOH ==NaCl + H2O
(2)根据上面的分析和推理,对四种基本反应类型是否属于氧化还原反应,作出恰当概括:
置换反应 都是氧化还原反应; 化合反应 有单质参加的是氧化还原反应;
分解反应 有单质生成的是氧化还原反应;复分解反应 都不是氧化还原反应。
4.化学反应基本类型
 ⑴ 化合反应:(多变一) A + B + … M
⑴ 化合反应:(多变一) A + B + … M
 ⑵ 分解反应:(一变多) M A +
B + …
⑵ 分解反应:(一变多) M A +
B + …

 ⑶ 置换反应:(单换单) A + BC AC + B 或A +
BC AB
+ C
⑶ 置换反应:(单换单) A + BC AC + B 或A +
BC AB
+ C
 ⑷ 复分解反应:AB
+ CD
AD + CB
⑷ 复分解反应:AB
+ CD
AD + CB
(中和反应属于复分解反应中的一种,是酸和碱作用生成盐和水的反应)
金属活动性顺序:______________________________________________________________________。
金属和盐反应:前换后,盐须溶,铁铜+2价,不用钾钙钠。
3.化学方程式
(1)质量守恒定律 参加化学反应的各物质质量_______,等于反应后生成的各物质的质量_______,这个规律叫质量守恒定律。质量守恒的原因是:化学反应的过程,就是原子的重新组合过程,在这个过程中,反应前后原子的________、_______、______都没有改变,因此化学反应前后各物质的质量总和必然相等。
[注意]化学反应前后⑴一定改变的是:①物质种类,②分子种类;⑵一定不变的是:①物质总质量,②元素种类③元素质量④原子种类⑤原子个数⑥原子质量;⑶可能改变的是:①分子个数②元素的化合价
[思考1]将一定质量的镁条在空气中点燃,完全燃烧后,生成氧化镁的质量与镁条相比,是不变,增大还是减小?为什么?
答:增大。因为镁条在空气中燃烧,是镁和氧气发生了化学反应,根据质量守恒定律,反应后生成氧化镁的质量必定等于镁条的质量和参加反应的氧气的质量之和,所以,氧化镁的质量比镁条的质量增大。
[思考2]把6.2g 红磷放在给定的氧气中充分燃烧,实验数据如下:
⑴这三次实验,哪一次符合质量守恒定律?为什么?⑵第一次实验为什么不生成10.2g 的五氧化二磷?哪种物质有剩余?剩余多少?③第二次实验为什么不生成24.2g 的五氧化二磷?哪种物质有剩余?剩余多少g ?
|
|
第一次 |
第二次 |
第三次 |
|
给定氧气的质量/g |
4 |
18 |
8 |
|
生成五氧化二磷的质量/g |
7.1 |
14.2 |
14.2 |
答:在这三次实验的化学反应中,都遵循质量守恒定律。反应中剩余的一部分不参加反应。参加反应的那部分物质和生成物的质量相等,均符合质量守恒定律。第一次实验中,4g O2只能和3.1g P反应生成7.1g P2O5 ,所以不能生成10.2g P2O5 。P有剩余,剩余3.1g 第二次实验,6.2gP只能和8g O2反应生成14.2g P2O5 ,所以不能生成24.2g P2O5 。O2有剩余,剩余10g 。
[练习]将25g 甲物质跟5g 乙物质发生反应,所得混合物中含有10g 甲物质、11g 丙物质,还有另一种物质丁,若甲、乙、丙、丁的相对分子质量分别为30、20、44、18,化学式分别为A、B、C、D,则表示它们之间的化学方程式正确的是
A.A+B=C+D B.2A+B=C+2D C.2A+B=2C+D D.A+2B=2C+D
(2)化学方程式 用化学式来表示____________的式子叫化学方程式。
㈠ 书写原则:一是必须以_____________为基础;二是要遵守_____________________________。
㈡ 化学方程式的意义:① 表示反应物、生成物和反应条件;② 表示各物质间的质量比。
[思考]点燃的镁带可以在二氧化碳 气体中继续剧烈燃烧,生成炭和氧化镁,其反应的方程式为_______________________________。从这个化学方程式中你可获得哪些化学信息:
①________________________________________________________________;
②________________________________________________________________;
③________________________________________________________________;
④________________________________________________________________。
2.化学式 用_________来表示物质_______的式子叫化学式。
(1)意义:①表示一种物质;②表示这种物质的一个分子;③表示这种物质的组成元素;④表示这种物质的分子的构成。如:H2O表示①水;②一个水分子;③水由氢、氧元素组成;④每个水分子由两个氢原子和一个氧原子构成。
[思考]维生素C的化学式为C6H8O6。它主要存在于蔬菜和水果中,它能促进人体生长发育,增加人体对疾病的抵抗能力;近年来,科学家又发现它还有防癌作用。从维生素C的化学式C6H8O6,你可以知道哪些信息(即化学式的意义)?要求至少写出三项:①________________________________________;
②_____________________________________________; ③____________________________________;
④__________________________________________。
 (2)化学式写法:
(2)化学式写法:
A.单质:①直接用元素符号表示
②双原子分子构成气态非金属单质:如:H2、O2、N2、Cl2等
B.化合物:一排位(正前负后),二标价,三约简,四交叉。
⑶“2”的位置及意义:
① 2H:表示2个氢原子。② H2:表示一个氢分子由两氢原子构成。③ 2CO:表示2个一氧化碳分子。④ Cu2+:表示铜离子带2个单位正电荷。⑤ CuO:氧化铜中铜元素的化合价为+2价(注意:Cu:铜元素化合价为+2价)⑥ CaSO4· 2H2O:表示构成一个生石膏分子的结晶水的数目是2。
[练习]指出下列符号中“2”的意义:
① 2H _______________________________________;② H2_______________________________;③ 2H2 ______________________________________;④ 2H+_______________________________;
⑤ Mg2+________________________;⑥ Mg____________________________。
1.元素符号 表示元素的符号。其含义有:① 表示一种元素,② 表示这种元素的一个原子。 如:O表示①氧元素;②一个氧原子。2O表示二个氧原子。
2. 元素
⑴ 具有___________(即质子数)的一类原子总称为元素。元素是宏观概念,只讲种类,不讲个数;元素与元素之间的区别是________________;
⑵ 同一种元素的原子或离子具有相同的质子数,但质子数相同的粒子不一定是同一种元素,如F和OH-的质子数都是9。
⑶ ①地壳中含量最多的四种元素为:氧(O)、硅(Si)、铝(Al)、铁(Fe)。②细胞中含量最多的四种元素为:氧(O)、碳(C)、氢(H)、氮(N)。③土壤中常缺乏的三种元素是:氮(N)、磷(P)、钾(K)。
⑷元素的性质与原子结构关系
|
元素的分类 |
最外层电子数 |
稳定性 |
化学性质 |
|
稀有气体元素 |
一般是8个(氦为2个) |
稳定 |
相对稳定不易得失电子 |
|
金属元素 |
较少(一般少于4个) |
不稳定 |
易失最外层电子 |
|
非金属元素 |
较多(一般4-7个) |
不稳定 |
易得电子 |
①元素的性质,特别是化学性质主要由元素原子的______________决定;
②元素的分类由元素原子的_______________决定;
③元素的种类由元素原子的_______________决定;
④决定元素化合价的粒子是原子的最外层电子数;
⑤决定原子质量的大小主要是原子核内质子与中子的质量。
⑸物质宏观上由元素组成,微观上由粒子(分子、原子、离子)构成。举例说明物质组成与构成的说法:
㈠ 由分子构成的物质,有三种说法(以二氧化碳为例)
① 二氧化碳是由氧元素和碳元素组成的。
② 二氧化碳是由二氧化碳分子构成的。
③ 每个二氧化碳分子是由两个氧原子和一个碳原子构成的。
㈡ 由原子(或离子)直接构成的物质(如汞、氯化钠),有两种说法:
① 汞是由汞元素组成的;氯化钠是由钠元素和氯元素组成的。
② 汞是由汞原子构成的;氯化钠是由钠离子和氯离子构成的。
[思考]在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,并填在相应的横线上。
①能直接构成纯净物的是 ②能保持物质化学性质的是
③化学变化中最小的粒子是 ④带正电荷的是
⑤不显电性的是 ⑥质量最小的是
⑦质量与氢原子近似相等的是 ⑧决定元素种类的是_______
⑹离子化合物与共价化合物 由_____________相互作用而构成的化合物叫离子化合物,如____________ 以___________形成分子的化合物叫共价化合物,如_______________。
⒊ 物质的分类
⑴混合物是由________________混合而成的。对于由分子构成的物质,混合物是由多种分子构成的。混合物的特点是无固定的组成和性质,无固定的熔点和沸点。混合物中各纯净物保持着各自的性质,相互间没有发生反应。
⑵ 纯净物是由一种物质组成的。对于由分子构成的物质,纯净物是由同种分子构成的。纯净物的特点是有固定的组成和性质,有固定的熔点和沸点。
⑶ 单质是由________元素组成的纯净物。化合物是由________元素组成的纯净物。
[思考]由同一种元素组成的物质一定是单质吗?_________________________________________
⑷ 无机物是指不含碳的化合物;有机物是指含碳的化合物。
[思考]CO、CO2、H2CO3和碳酸盐是有机物吗?__________________________________________
⑸酸 电离时生成的阳离子全部是氢离子的化合物叫酸。
[思考]NaHSO4是酸吗?为什么?________________________________________________________
① 含氧酸:酸分子中含有氧原子的酸,如_______、________;
② 无氧酸:酸分子中不含氧原子的酸,如______、________。
⑹碱 电离时生成的阴离子全部是氢氧根离子的化合物叫碱。
[思考] Cu2(OH)2CO3是碱吗?为什么?___________________________________________________
①可溶性碱:NaOH、KOH、Ba(OH)2、Ca(OH)2
②难溶性碱:Cu(OH)2 (蓝色)、Fe(OH)3(红褐色)、Mg(OH)2(白色)
⑺ 盐 电离时生成金属离子和酸根离子的化合物叫盐。
[思考]
◆写出下列盐的化学式,并命名:
①正盐:_____________________________________________________;
②酸式盐:___________________________________________________;
③碱式盐:___________________________________________________。
◆盐的组成中一定含有金属元素吗?__________________________________________________
⑻ 氧化物 含氧双元素的化合物叫氧化物。
①酸性氧化物 凡能跟_______起反应,生成___________的氧化物,如:_________________________。
②碱性氧化物 凡能跟________起反应,生成_________的氧化物,如:__________________________。
第五课时 化学用语与化学量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com