
题目列表(包括答案和解析)
28.(5分)随着工业与交通运输业的迅速发展,有害气体和烟尘的排放
,对空气造成了严重的污染,控制大气污染的主要途径是减少排放
(1)曾经有过一段时间,许多工厂试图通过建造很高的烟囱来解决排放
问题,然而这样做并没有达到目的,原因是_______________________
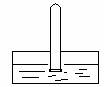
如今,他们通过在烟囱中安装了过滤装置,可以有效地控制________的排放;安装烟囱净化洗涤装置(如图所示)可以除去废气中部分有害气体,根据该装置的净化原理分析,被除去的有害气体所具有的共同性质是______________________。
(2)按规定汽车应安装尾气处理装置,如在排气管上安装催化转化装置,使尾气中的一氧化碳与一氧化氮在催化剂的作用下,转化为二氧化碳和氮气,该反应的化学方程式为 __________ __________________。
(3)在控制大气污染方面,你认为还有哪些措施或途径,请写出其中的一种:
_____________________________________________________________________________。
27.(2分)根据下表填空
|
气体 |
二氧化氮 |
 一氧化氮 一氧化氮 |
|
颜色 |
棕色 |
无色 |
|
溶解性 |
易溶于水 |
微溶于水 |
|
反应 |
3NO2+H2O==2HNO3+NO |
(HNO3,即硝酸,是化学常见的强酸之一,易溶于水)
如右图所示,将一支充满二氧化氮的棕色气体的试管倒立在水槽中,试描述试管内可能出现的实验现象。
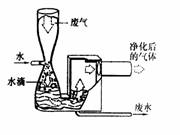 ①__________________________________________
①__________________________________________
②__________________________________________。
26.(6分)下表是硝酸钾和氯化钠两物质在不同温度下的溶解度
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
硝酸钾(g) |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
202 |
246 |
|
氯化钠(g) |
35.5 |
35.8 |
36 |
36.3 |
36.6 |
36.9 |
37.3 |
37.7 |
38.4 |
39 |
39.9 |
(1)根据以上溶解度数据,在下面坐标纸上完成硝酸钾及其氯化钠的溶解度曲线
(2)由上图可知:两物质的溶解度受温度影响较小的是____________;当温度________℃时,硝酸钾的溶解度大于氯化钠的溶解度。
(3)若硝酸钾中混有少量的氯化钠,可采取__________方法提取KNO3。
(4)在90℃时,若有1000g饱和的硝酸钾溶液,则该饱和溶液中溶质质量分数为_________。
25.(3分)在赤壁之战中,周瑜的军队点燃战船,熊熊燃烧的战船借助东风直冲曹军的大船,使曹军的木船燃起大火,根据我们学过的燃烧条件的填写:曹军的木船是______,木船燃烧的条件是________、_______。
24.(1分)课本上有“烧不坏的手帕”实验:将2体积95%的酒精和1体积的水混合。把一块棉布手绢浸入配好的混合液中,浸透后取出,轻轻拧干,用坩埚钳夹持,在酒精灯上点燃,并轻轻抖动手绢。火熄灭后,观察到原来浸透酒精的手绢并没有烧毁,其中的原因为________________________________________。
23.(2分)金属材料在生活中普遍使用。铁制品表面的锈要及时除去,这是因为铁锈结构___________,会加快铁制品的生锈。铝制品不需要除锈,这是因为铝表面能形成_____________,可以阻止铝进一步氧化。
22.(3分)(1)实验室现有质量分数为10%的NaOH溶液100g,由于实验要求,急需一定量的20%的NaOH溶液,我们可以往10%的溶液中加入NaOH固体_________g,或者蒸发水________g均可达到目的。
(2)现有t℃下200g某物质的溶液,若蒸发掉20g水后,析出固体为5g,若蒸发30g水,析出固体为15g,则在t℃下该物质的溶解度为____________g。
21.(6分)请用化学方法除去下列各组物质中括号中的物质,写出化学方程式,并标明化学反应类型。
(1)铜粉(铁粉)_______________________________________________( );
(2)生石灰(石灰石)___________________________________________( );
(3)二氧化碳(氧气)_______________________________________( );
(4)氯化钠(碳酸钠)_______________________________________;
(5)一氧化碳(二氧化碳)_______________________________________;
20.(3分)用数字和化学符号表示。
2个钠离子__________; (2)3个氢氧根离子__________;
(3)保持氧气的化学性质的微粒_________; (4)碳酸钠中碳元素的化合价为+4价___ ___;
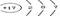 (5)n个硅原子_____________ (6)
表示的微粒是__________。
(5)n个硅原子_____________ (6)
表示的微粒是__________。
19.(4分)(1)“侯氏制碱法”关键一步的反应原理为:NH3+CO2+H2O+NaCl==NaHCO3↓+A,则A为___________(填化学式),A中氮元素的化合价为_________。
(2)请选用C、H、O、Ca四种元素中的一种或者是几种写出符合下列要求的化学式:
①打开汽水瓶盖时,大量逸出的气体__________;②溶于水后会放出大量的热的固体_____________;
③我国建设的“西气东输”工程中,这里的“气”指的是___________;
④在抢救危急病人时,用呼吸机输入的单质气体是___________;
⑤相对分子质量最小的氧化物_______________;
⑥具有可燃性,炼铁过程中产生大量的高炉气中的主要成分_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com