
题目列表(包括答案和解析)
1. 世界是物质的,物质是变化的。下列属于物理变化的是 ( )
A.冰雪融化 B.钢铁生锈 C.牛奶变酸 D.食物腐败
26.(9分)某校化学兴趣小组的同学经查阅资料知道:淀粉在适当温度和酸催化条件下可转变为葡萄糖。为探究淀粉在不同温度下转化为葡萄糖的程度,他们每人都进行了如下两步实验:
步骤1. 用一支大试管取一定量淀粉与水混合,再加入适量的稀硫酸,摇匀,加热到一定的温度。实验过程中,各人控制温度不同,加热持续时间相同。
步骤2.然后用两支小试管各取少量大试管内的反应混合物,在其中一支小试管(编号为A)内滴加NaOH溶液至呈强碱性,再滴入4-5滴CuS04溶液,并加热至沸;在另一支小试管(编号为B)内滴加2-3滴碘水。观察并记录现象。
(1)由于各人控制的温度不同,出现了下列三种情况。请你根据已学知识,帮助他们完成下列实验情况汇总表。
|
|
现
象 |
结
论 |
|
第一种 情 况 |
A试管中:____________________________ B试管中:____________________________ |
淀粉没有转化为葡萄糖 |
|
第二种 情 况 |
A试管中:____________________________ B试管中:____________________________ |
______________________ |
|
第三种 情 况 |
A试管中:____________________________ B试管中:____________________________ |
淀粉全部转化为葡萄糖 |
(2)在步骤2中A试管内所加Na0H溶液的作用是 。
25.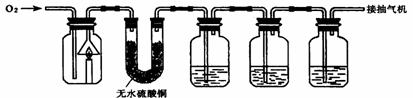 (8分)化学小组的同学为验证蜡烛(主要成分是石蜡)的燃烧产物,并测定蜡烛中碳、氢两种元素的质量比,设计的实验装置如下(注:反应前全套装置中残留的空气及反应后A瓶内残留的燃烧产物均忽略不计,且各装置均能吸收完全)。
(8分)化学小组的同学为验证蜡烛(主要成分是石蜡)的燃烧产物,并测定蜡烛中碳、氢两种元素的质量比,设计的实验装置如下(注:反应前全套装置中残留的空气及反应后A瓶内残留的燃烧产物均忽略不计,且各装置均能吸收完全)。
A B C D E
(1)实验步骤有:①称量②再称量③点燃蜡烛,并通入氧气(控制氧气流量)④停止通氧气,使蜡烛熄灭⑤按图示连接仪器⑥将装置冷却至室温。则实验步骤的顺序是(填数字序号) ______。
(2)可供选择的试剂有:稀硫酸、浓硫酸、盐酸、澄清石灰水、氢氧化钠浓溶液等。则装置C、D中所盛放的试剂依次为_________、________;装置E的作用是__________________________。
(3)为测定蜡烛中碳、氢两种元素的质量比,反应前、后必须称量装置(填装置序号) _______________的质量。
24. (5分)向试管中放入几小块镁片,把试管固定在盛有饱和石灰水(25℃)的烧杯中,再向试管中滴入约5mL盐酸,如右图所示。请回答:
(1)实验中观察到的明显现象有:①剧烈反应,有气泡产生;
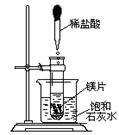 ②镁条逐渐溶解;③_________________(2)产生上述现象③的原因是:①_______________________;②___________________。
②镁条逐渐溶解;③_________________(2)产生上述现象③的原因是:①_______________________;②___________________。
(3)写出相关的化学反应方程式:
23. (6分)
(1)写出编号①和②仪器的名称:① ②
(2)实验室用KMn04制O2时,应选用 做气体发生装置。已知MnO2固体和浓盐酸混合共热可制得氯气(Cl2),则应选用 做气体发生装置。
(3)有一名同学欲用F装置收集O2,则O2应从导管口 通入;另有一名同学欲用G装置收集O2,则O2应从导管口 通入。
22.(4分)我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。右表是几种物质在不同温度时的溶解度:
(1)从表中数据可以看出,温度对____________的溶解度影响不大。
(2)要使饱和溶液中的NH4C1结晶析出,在____(填“较高”或“较低”)温度下进行比较合适。
(3)“侯氏制碱法”制NaHC03的方程式是NaCl+C02+NH3+H20=NaHC03+NH4Cl,该反应能进行的原因是____________________________________________________________。
21.(8分)将铜、锌两种金属的混合物20g,放入100g稀硫酸中恰好完全反应,共放出0.2g氢气。求:⑴原混合物中锌的质量。 ⑵反应后所得溶液的质量分数。
|
|
0℃ |
20℃ |
40℃ |
60℃ |
|
NaHC03 |
6.9 |
9.6 |
2.7 |
6.4 |
|
NaCl |
35.7 |
35.8 |
6.6 |
37.3 |
|
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
20. (6分)甘油在印刷、化妆品等工业中常用作润湿剂,也可用来制造医药和炸药。
(1)根据甘油的化学式C3H8O3, 你能得出哪些信息?(任写四条)① ;② ;③ ;④ ;
(2)瑞典化学家诺贝尔是安全使用硝化甘油炸药的第一人。硝化甘油(C3H5N3O9)是意大利化学家索布赖罗利用甘油和某物质X在一定条件下合成的,该反应的化学方程式为:C3H8O3+3X==C3H5N3O9 +3H2O 。则X的化学式为 。
19.(12分)根据下列要求写出相关的化学反应方程式并分别指出属于何种反应类型:
(1)高温煅烧石灰石 ,属于 反应;
(2)铁钉放入硫酸铜溶液中 ,属于 反应;
(3)红磷燃烧 ,属于 反应;
(4)盐酸和氢氧化钠溶液反应 ,属于 反应;
18.(4分)学习了化学可以帮助我们解释生活中的一些现象:
(1)高层建筑常采用铝合金门窗,而不采用铁门窗。
(2)富含维生素C的的蔬菜烹调时不能加热时间过长,是因为维生素C 。
(3)活性炭可用于除去色素或臭味,是因为活性炭具有 能力。
(4)50mL水和50mL酒精混合在一起,总体积小于100mL。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com