
题目列表(包括答案和解析)
2、二氧化碳
⑴、CO2 的化学性质
① CO2不能燃烧,不支持燃烧,也不能供给呼吸。(但CO2是无毒的)
② CO2跟水反应生成碳酸 CO2+ H2O ===H2CO3
碳酸能使紫色石蕊试液变红,碳酸不稳定,很易分解成水和二氧化碳。H2CO3 === CO2 + H2O
③ CO2能使澄清石灰水变浑浊 CO2 + Ca(OH)2 ==CaCO3 ↓+ H2O
⑵ 、二氧化碳的重要用途
①灭火②工业原料可制纯碱、尿素和汽水③干冰可作致冷剂、可用于人工降雨④温室肥料。
⑶、CO2的工业制法--高温煅烧石灰石或大理石: CaCO3 
 CaO + CO2 ↑
CaO + CO2 ↑
⑷、CO2 的实验室制法
①、药品:大理石或石灰石、稀盐酸
②、原理:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
③、仪器装置
④、实验步骤:查、装、定、加、收。
1、H2、CO、C还原CuO实验的比较
|
|
H2还原CuO |
CO还原CuO |
C还原CuO |
|
|
化学方程式 |
H2+CuO  Cu + H2O Cu + H2O |
CO+CuO  Cu +CO2 Cu +CO2 |
C +2 CuO  2Cu +CO2↑ 2Cu +CO2↑ |
|
|
装置图 |
 |
 |
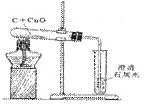 |
|
|
装置特点 |
①试管口略向___倾斜;②通H2 的导管伸至试管底部于CuO 上方 |
因CO有____,增加对尾气处理装置,防止CO污染空气 |
①试管口略向下倾斜;②反应需高温; |
|
|
操作步骤 |
反应前需检验气体纯度。还原过程分四步:一通,二点,三撤,四停 |
①检查气密性;②装药品固定试管;③点燃;④移导管,熄灭酒精灯。 |
||
|
实验现象 |
①黑色CuO 变成___色;②试管口有___生成 |
①黑色CuO 变成___色;②生成的气体使澄清石灰水变浑浊 |
①黑色固体逐渐减少;②有光亮红色固体生成;③生成的气体使澄清石灰水变浑浊 |
|
O2、H2、CO2的实验室制法比较
|
|
氧气(O2) |
氢气(H2) |
二氧化碳(CO2) |
|
反应原理 |
 2KClO3 2KCl
+ 3O2↑ 2KClO3 2KCl
+ 3O2↑2KMnO4  K2MnO4 +MnO2+O2↑ K2MnO4 +MnO2+O2↑ |
Zn +H2SO4== ZnSO4+H2↑ Zn + 2HCl =ZnCl2 + H2↑ |
CaCO3+2HCl== CaCl2+H2O+CO2↑ |
|
发生装置 |
 |
 |
 |
|
收置方法 |
①向上排空气法(密度比空气大); ②排水法(不易溶于水) |
①向下排空气法(密度比空气小); ②排水法(难溶于水) |
只能用向上排空气法(密度比空气大,能溶于水) |
|
操作步骤 |
①组装仪器②检查装置的气密性③装药品④固定装置⑤加热⑥收集气体⑦把导管撤出水槽⑧熄灭酒精灯。 |
①组装仪器②检查装置的气密性③加药品④验纯⑤收集气体 |
①组装仪器②检查装置的气密性③加入大理石④从漏斗注入稀盐酸⑤收集气体 |
|
验
满 |
向上排空气法收集时,用带火星的木条放在集气瓶口,木条复燃,说明收集已满。排水法收集时,气泡往集气瓶外冒时,收集已满。 |
用排水法收集时,当气泡往外冒时,说明收集已满。 |
用燃着的木条放在集气瓶口,若木条熄灭,说明收集已满。 |
|
检验或验纯 |
验证:用带火星木条伸入集气瓶内,木条复燃,说明是氧气 |
验纯:收集一试管氢气,用大拇指堵住,管口向下,移近酒精灯火焰,若发出微弱的“噗”的一声,说明氢气已纯,若发出尖锐的爆鸣声,说明氢气不纯,应再收集再检验。 |
验证:通入澄清石灰水,石灰水变浑浊,说明是二氧化碳。 [CO2 +Ca(OH)2 == CaCO3↓+H2O] |
|
注 意 事 项 |
试管口应略向下倾斜,以防水倒流至试管底部,使试管炸裂;排水法收集时当气泡连续均匀冒出时开始收集,以免收集气体不纯;排水法收集完后,先将导管移出水槽,再停止加热,以免水槽中的水倒流至热试管,使试管炸裂。 |
长颈漏斗下端应伸入液面以下,以免生成的气体从长颈漏斗中逸出;用排空气法收集时,导管应伸入集气瓶底部;验纯时,浓盐酸有挥发性,浓硫酸、硝酸具有强氧化性,
Cu 等金属不与稀酸反应,所以都不宜用来制氢气。 |
不能用稀H2SO4 代替稀盐酸,因为稀H2SO4 与CaCO3 反应生成微溶性的CaSO4 覆盖在CaCO3表面,从而阻止反应的进一步进行。 |
◆实验室制取气体的思路和方法:
①首先要研究实验室制法的反应原理,即在什么条件下,用什么药品通过什么反应,制取这种气体。②其次根据反应物的状态、反应条件和生成气体的性质来设计实验装置。
③最后还要研究如何验证制得的气体就是所需要的气体。
练习
1、 一氧化碳的化学性质
① 可燃性--作燃料2CO + O2  2 CO2 现象:燃烧时发出蓝色火焰,放出热量。
2 CO2 现象:燃烧时发出蓝色火焰,放出热量。
② 还原性--冶炼金属
CO+CuO  Cu + CO2 现象:黑色氧化铜变成红色,同时生成能使澄清石灰水变浑浊的气体。
Cu + CO2 现象:黑色氧化铜变成红色,同时生成能使澄清石灰水变浑浊的气体。
③ 毒性 一氧化碳易与血液中的血红蛋结合,使血红蛋白丧失了与氧结合的能力。
(CO排放到空气中会造成空气污染,一半以上的CO来自汽车排放的废气,其余主要来自煤等燃料的燃烧和石油炼制、钢铁冶炼等,森林火灾、海洋和陆地生物的腐烂过程也能产生CO )
1、碳的几种单质
⑴ 金刚石和石墨的物理性质用途对比:
|
|
金刚石 |
石墨 |
|
组成元素 |
碳 |
碳 |
|
外观 |
无色透明正八面体状晶体 |
深灰色、不透明细鳞片状固体 |
|
光泽 |
加工琢磨后有夺目光泽 |
有金属色泽 |
|
硬度 |
天然存在的最硬物质 |
最软的矿物质之一 |
|
熔点 |
高 |
高 |
|
润滑性 |
无 |
良好 |
|
导电、导热性 |
无 |
良好 |
|
用途 |
钻探机的钻头、玻璃刀、装饰品等 |
电极、铅笔芯、特别是高温工作中的机器的润滑剂 |
⑵ 碳的化学性质
碳在常温下性质稳定,在高温下,碳能跟许多物质起反应。(想一想:碳的化学性质与哪种物质相似?)
① 可燃性: (都放热-可作燃料)
C + O2  CO2(充分燃烧) 2C + O2
CO2(充分燃烧) 2C + O2  2CO(不充分燃烧)
2CO(不充分燃烧)
② 还原性:(--冶炼金属)
2CuO + C  2Cu + CO2 ↑
C + CO2
2Cu + CO2 ↑
C + CO2  2CO(吸热反应)
2CO(吸热反应)
现象:黑色氧化铜变成红色,澄清石灰水变浑浊。 现象:黑色粉末不断减小
碳的氧化物
31.(8分)机动车排放的尾气是空气的重要污染源,其成分之一是NO。某化学兴趣小组的同学在查阅资料后得知:①NO常温下是一种无色、难溶于水的气体,它的密度比空气略大;②NO常温下能与氧气迅速反应,生成红棕色的NO2气体:2NO2+O2=2NO2;③实验室常用铜与稀硝酸反应制取NO:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑十4X。
根据以上信息完成下列问题:
(1) 物质X的化学式为______________。
(2) 若选择合适的装置来制取并收集NO气体,就选择的发生装置是 ,收集装置是 。

(3) 实验时在发生装置中可以观察到:铜片不断溶解并得到蓝色溶液,还能观察到的现象有__________________________________________________________________________。
(4) 该小组的同学通过查阅资料还得知:①NO容易和血红蛋白结合而使人中毒;②NO能抗击侵入人体的微生物,并能阻止癌细胞的繁殖和肿瘤细胞的扩散。综合分析①和②的信息,你得到的启示是 。
(5) 某化工厂准备生产Cu(NO3)2,以铜和稀硝酸为主要原料设计了两种方案:
方案一:3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑十4X;
方案二:2Cu+O2 △ 2CuO CuO+2HNO3==Cu(NO3)2+H2O
从环境保护的角度考虑,你认为较合理的方案是____________。从经济效益的角度考虑,选择此方案的另一条理由是__________________________________________________________。
30.(8分)某城市固体废弃物处理场位于该市郊区,占地面积2600多亩。它是市政府为科学有效地处理生活垃圾而建设的一项重要城市基础设施工程。垃圾处理的操作流程为:计量→倾倒→推平→压实→消杀→覆土→封场→绿化;对垃圾填埋后产生的气体经导排系统收集后用于供热或发电;对垃圾渗透漏液经调节池集中收集后通过日处理达1500 t的污水处理厂进行生物和化学处理,达到国家二级排放标准后排放。该固体废弃物处理场为提高城市环境质量,促进城市文明建设和实现可持续发展奠定了良好的基础。
(1)说出填埋法处理城市垃圾的优点与缺点各一条。
(2)垃圾填埋后会产生沼气,沼气燃烧可用于供热或发电,写出其完全燃烧的化学方程式。
(3)处理污水时,你认为采取的化学方法处理污水的措施可有哪些?(至少答两点)
(4)我市将投资4.89亿元从国外引进先进的焚烧发电设备来处理城市生活垃圾。说出焚烧法处理城市生活垃圾的优点和缺点各一条。
29.(6分)镁条在空气中易被氧化,有一根在空气中放置一段时间的镁条样品,其质量为2.56g,把该样品与足量的稀硫酸反应得到氢气0.18g。
问:(1)样品中未被氧化的镁的质量是多少?
(2)该镁条未被氧化时的质量是多少?
28.(4分)现有500 mL溶质质量分数为10%的氯化钾溶液(密度约为1.1g/mL)。问:
(1)溶液中含氯化钾多少克?
(2)向上述溶液中加入等体积的水后(水的密度为1.0g/mL),溶液的溶质质量分数变为多少?(计算结果请用百分数表示且保留一位小数)
27.(6分)以下是一些常见物质间互相转化的关系图(有些反应条件已省略):已知高温下CO能与多种金属氧化物反应生成相应的金属和CO2。下列关系图中,A、B、X、Y均为无色气体,E、F为常见金属。

试回答:(1)根据上图判断B的化学式为______________;Y的化学式为______________。
(2)写出蓝色溶液与E反应的化学方程式:________________________________。
(3)X除了与黑色固体甲、乙反应外,请再举一例说明X还能发生化合反应,写出反应的化学方程式:_____________________________________________________。
26.(6分)某学校研究性学习小组,以一工厂生产过程中产生的废弃物“红色铁泥”为研究对象,探究红色物质的成分,请你参与他们的活动。
[小组讨论]
甲观点:红色物质是铜。
乙观点:红色物质是氧化铁。
丙观点:红色物质是氢氧化铁。
丁观点:红色物质是氧化铁和氢氧化铁的混合物。
[查阅资料]
■ 该厂的“红色铁泥”主要是生产过程中使用铁触媒(一种催化剂)后的废弃物。
■ “铁泥”中除红色物质外,还含有受热不分解、不与酸、碱或氧气等反应、不溶于水的物质。
■ 氢氧化铁受热易分解成氧化铁和水。
[提出假设]
乙、丙、丁三种观点存在合理性。
[实验验证]
Ⅰ 取适量“红色铁泥”晒干,称量其质量为m1 g。
Ⅱ 将“红色铁泥”置于坩埚中充分加热并在干燥器中冷却后,称量其质量为m2 g。
请回答下列问题:
⑴当m1=m2时,则红色物质为 。
⑵当m1>m2>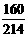 m1时,则“红色铁泥”中一定含有氧化铁吗?
(填写“一定”或“不一定”),理由是
。
m1时,则“红色铁泥”中一定含有氧化铁吗?
(填写“一定”或“不一定”),理由是
。
⑶假定“红色铁泥”中“红色物质”是氢氧化铁,请写出回收“红色铁泥”中的铁元素制得“铁红”(化学式为Fe2O3,一种重要的涂料)过程中的化学方程式:
① ;
② ;
③ 。
25.(7分)工业上是用氨气还原氧化铜制取铜的。某校化学兴趣小组为探究该反应能否进行并验证其生成物,查阅了大量资料并设计了一系列实验。
查阅到的信息:
⑴ 氨气是一种无色、有刺激性气味的气体,不易燃,密度比空气小,极易溶于水,氨水显碱性。实验室常用加热氯化铵晶体和熟石灰固体混合物的方法制取氨气,同时生成氯化钙和水。
⑵ 氨气还原氧化铜制取铜的反应原理:2NH3+3CuO===3Cu+N2+3H2O
某小组设计了如下实验装置并进行实验:
 氯化铵和熟石灰 生石灰
氯化铵和熟石灰 生石灰
A B C
试回答:
⑴ 装置A的作用是 ,反应物中的氯化铵可用___________代替(写出一种替代物的化学式)。
⑵ 装置B所起的作用是 。
⑶ 装置C中可观察到的实验现象是 。
⑷ 你认为该小组的实验设计还存在的不足是 。(说出一点即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com