
题目列表(包括答案和解析)
5.下列说法正确的是
A.饱和溶液一定是浓溶液
B.不饱和溶液一定是稀溶液
C.饱和溶液一定比不饱和溶液浓
D.同温下氯化钠的饱和溶液一定比不饱和溶液浓
4.下列物质的溶解度随着温度的升高而减小的是
A.氯化钠 B.氢氧化钙
C.硝酸钾 D.硝酸钠
3.影响固体溶解度的因素主要是
A.溶质的质量 B.溶剂的质量
C.温度的高低 D.压强的大小
2.在一定的温度下,某物质的饱和溶液一定是
A.很浓的溶液
B.很稀的溶液
C.不能继续溶解任何物质的溶液
D.不能溶解该溶质的溶液
1.下列物质加入水中,能得到溶液的是
A.米粉 B.酒精 C.花生油 D.泥土
6.100 g盐酸跟20 g CaCO3粉末恰好完全反应。求:
(1) 盐酸中溶质的质量分数。
(2) 生成溶液的溶质的质量分数。
解析:这是涉及化学反应的有关质量分数的计算,由于发生了化学反应,溶液中的溶质要发生变化,因此,要正确找出溶液中的溶质。溶液的质量可以通过质量守恒法,即用反应前物质的总质量减去生成的气体或沉淀的质量,就可以得到生成物溶液的质量。
设反应掉的HCl质量为x,生成物的质量为y,生成的CO2的质量为z,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
20 g x y z
 =
= , x=14.6 g
, x=14.6 g
 =
=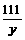 , y=22.2 g
, y=22.2 g
 =
= , z=8.8 g
, z=8.8 g
(1) 盐酸中溶质的质量分数为: ×100%=14.6%
×100%=14.6%
(2) 生成物溶液的质量为:100 g+20 g-8.8g=111.2 g
生成物中溶质的质量分数为: ×100%=20%
×100%=20%
答:(1) 盐酸的质量分数为14.6%;(2) 生成溶液中溶质的质量分数为20%。
5.实验室配制50 g质量分数为5%的食盐溶液,回答下列问题:
(1) 实验所需的实验用品有 ;
(2) 在托盘天平上称量 g食盐,用 (填序号)的量筒取 mL的水;
A. 10 mL B. 100 mL C. 200 mL D. 500 mL
(3) 如果用量筒量取水时,仰视读数,那么所配制的食盐溶液中溶质的质量分数 (填序号)。
A. >5% B. =5% C. <5% D. 没有影响
解析:(1) 根据配制一定溶质质量分数的溶液实验步骤:计算、称量(量取)、溶解,可知:要称量固体食盐需要托盘天平和药匙,量取水时应用量筒和滴管,溶解时要将食盐和水放入烧杯中并用玻璃棒搅拌。
(2) 要配制50 g质量分数为5%的食盐溶液,需要食盐50 g×5%=2.5 g;需水的质量:50 g-2.5 g=47.5 g,水的体积: =47.5 cm3=47.5 mL。2.5 g食盐用托盘天平称取,47.5 mL水用量筒量取,但用200
mL和500 mL量筒误差较大,应选较接近的100 mL量筒。
=47.5 cm3=47.5 mL。2.5 g食盐用托盘天平称取,47.5 mL水用量筒量取,但用200
mL和500 mL量筒误差较大,应选较接近的100 mL量筒。
(3) 用量筒量取液体体积读数时,视线应与液体凹液面的最低处保持水平。如果仰视读数,所配溶液的质量分数比实际小。如仰视读数是47.5 mL,而水的体积实际上大于47.5 mL,所配制的食盐溶液中水的质量就大于47.5 g,溶液中溶质的质量分数就小于5%。
答:(1) 托盘天平、烧杯、玻璃棒、药匙、量筒、滴管
(2) 2.5 g;B;47.5 mL (3) C
4.20℃时,NaCl的溶解度为36 g。在20℃时,把20 g NaCl放在50 g水里充分溶解,所得溶液中溶质的质量分数 。
解析:本题涉及质量分数和溶解度的计算,关键是要明白溶解度的意义,找出溶质和溶液的量,并进行有关计算。
设20℃时,50 g水能溶解NaCl的质量为x,则
 =
= , 得 x=18 g
, 得 x=18 g
由NaCl的溶解度知,20 g食盐放入50 g水里并没有全部溶解,故形成的溶液是饱和溶液。
w= ×100%=26.5%
×100%=26.5%
(也可以用w= ×100%=26.5%)
×100%=26.5%)
答:26.5% 。
3.配制5000 mL质量分数为10%的硫酸溶液,需要质量分数为98%的硫酸多少mL?需水多少mL?(已知10%和98%的硫酸的密度分别为1.07 g / cm3,1.84 g / cm3)
解析:本题是溶液的稀释问题,其实质是加水的过程,其中溶质及其质量分数发生变化,但溶质质量不变。故此类题要抓住“稀释前后溶质的质量不变”的原则,同时要熟记溶液中溶质的质量分数的公式换算:
溶液中溶质的质量=溶液的质量×溶质的质量分数
溶液中溶质的质量=溶液体积×溶液密度×溶质的质量分数
解法一:设需要98%的硫酸质量为x,
5000 cm3×1.07 g / cm3×10%=x×98%, x=545.9 g
硫酸的体积= =296.7 cm3=296.7 mL
=296.7 cm3=296.7 mL
需水的质量=5000 cm3×1.07 g / cm3一545.9 g=4804.1 g,
水的体积= =4804.1 cm3=4804.1 mL。
=4804.1 cm3=4804.1 mL。
解法二:设需98%的硫酸的体积为y。
5000 cm3×1.07 g / cm3×10%=y×1.84 g / cm3×98%,
y=296.7 cm3=296.7 mL
需要加水的质量=5000 cm3×1.07 g/cm3一296.7 cm3×1.84 g / cm3=4804.1 g,
水的体积= =4804.1 cm3=4804.1 mL
=4804.1 cm3=4804.1 mL
答:需浓硫酸296.7 mL;水4804.1 mL。
2.将10 g胆矾(CuSO4·5H2O)溶解在90 g水中,完全溶解后,求所得溶液中溶质的质量分数。
解析:溶液中溶质的质量分数的计算,要弄清溶质和溶剂,以及溶质和溶液的量,按照公式即可计算。对于结晶水合物,溶质应为相应的无水物。如胆矾溶于水后,得硫酸铜溶液,溶液中的溶质不是CuSO4·5H2O,而是无水CuSO4。结晶水将转变为溶剂。
m(CuSO4)=10 g× =6.4 g
=6.4 g
w= ×100%=6.4%
×100%=6.4%
本题也可以算出结晶水量,按下式计算:
结晶水的质量为:10 g-6.4 g=3.6 g,溶剂水的质量为:3.6 g+90 g=93.6 g
w= ×100%=6.4%
×100%=6.4%
答:所得硫酸铜溶液中溶质的质量分数为6.4%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com