
题目列表(包括答案和解析)
| a |
| 200 |
| a |
| 200 |

 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 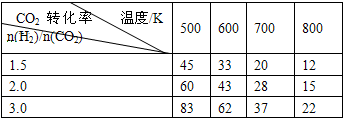


 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 

题 号
14
15
16
17
18
19
20
21
答 案
ACD
A
AC
BC
B
C
B
C
22.Ⅰ.(8分) BC;0.340;DE;0.336(各空得分依次为2分.2分.2分.2分)
 Ⅱ.(10分)(1) 连接电路如答案图(4分)
Ⅱ.(10分)(1) 连接电路如答案图(4分)
(2) A (2分)
(3) 1.6×
23.(15分)
解:设滑水者质量为m,AB间的最大高度差为H,从A运动到B的加速度为a,到B点的速度为v。
滑水者从A运动到B的过程中,根据牛顿第二定律得:
 ①
据运动学公式得:
①
据运动学公式得: ②
②
据几何关系得: ③
③
滑水者从滑道末端到水池边缘D的过程中,作平抛运动
 ④
④  ⑤
⑤
联立以上各式得: m ⑥
m ⑥
评分标准:本题共16分。正确得出①、②、③式各给3分;正确得出④、⑤、⑥式各给2分。
24.(19分)24.解: (19分)(1)滑块C滑上传送带做匀减速运动,当速度减为零时,滑动的距离最远。
由动能定理  2分 解得
2分 解得 =
=
(2)设A、B碰撞后的速度为v1,A、B与C分离时的速度为v2,由动量守恒定律
mv0=2mv1 2分
2mv1=2mv2+ mvC
2分 解得v1= ,v2=0
,v2=0
由能量守恒定律 Ep+ =
= 2分 解得Ep=4.0 J 1分
2分 解得Ep=4.0 J 1分
(3)因为v0>v,滑块在传送带上向右匀减速运动,设滑块C在传送带上运动的加速度为a,滑块速度减为零的时间为t1,向右的位移为s1,在同样时间内传送带向左的位移为x1,根据牛顿第二定律和运动学公式
a=
 =2.0
s 1分 s1=sm=
=2.0
s 1分 s1=sm=
x1=vt1=
设滑块C向左匀加速运动速度达到传送带速度v的时间为t2,位移为s2,这段时间内传送带的位移为x2,根据运动学公式
t2= =1.0s 1分 s2=
=1.0s 1分 s2= t2=
t2=
滑块C相对传送带滑动的总距离Dx=(x1+s1)+(x2-s2)
解得Dx =
滑块C与传送带之间因摩擦产生的内能Q=mmgDx =18 J 1分
25.(20分)
 解:⑴电磁场同时存在时,由粒子做匀速直线运动,设入射速度大小为v0得:
解:⑴电磁场同时存在时,由粒子做匀速直线运动,设入射速度大小为v0得:
 ① 2分
① 2分
撤去磁场后,粒子在电场中做曲线运动,  ② 2分
② 2分
 ③ 2分
③ 2分
只保留磁场时,粒子在磁场中做圆周运动  ④ 2分
联立以上各式解得:
④ 2分
联立以上各式解得: ⑤ 2分
⑤ 2分
⑵连接OP,作OP的中垂线交OP于O3点,若粒子沿v1方向射出,圆心为O1,据已知条件有 ⑥ 2分
⑥ 2分  .
. ⑦ 2分
⑦ 2分
据几何关系有: ⑧ 2分
⑧ 2分
因v1与 垂直,因此v1与x轴正方向所成夹角为
垂直,因此v1与x轴正方向所成夹角为 ,即
,即 ⑨ 2分
⑨ 2分
若粒子沿v2方向射出,同理可解得:
因v2与 垂直,因此v2与x轴 正方向 所 成 夹 角 为
垂直,因此v2与x轴 正方向 所 成 夹 角 为 ,即
,即 ⑩ 2分
⑩ 2分
理综19生物参考答案
1―5BDCDB
30.(20分)
I.(每空1分,共8分)
(1)伊红―美蓝 无氮
(2)次级 对数 稳定 连续培养
(3)4:1 3:1
II.(每空2分,共12分)
(1)从光斑照射开始到20s时,CO2吸收速率迅速上升;从20s到光斑移开时,CO2吸收速率缓慢上升(或基本不变) 光斑照射期间积累的ATP或NADPH,可以使暗反应持续一段时间
(2)CO2的浓度 光照强度
(3)> 氧气释放速率或二氧化碳吸收速率大于零
31.(第I部分每空2分,第II部分4分,共22分)
I.(1)果皮是由母本的子房壁发育而来,具有母体的遗传性状。
(2)③; ⑥; 子叶。
(3)喷洒适宜浓度生长素溶液或类似物溶液。
(4)4, 4
(5)基因突变;100%。
II.A与B杂交得杂交一代,杂交一代与C杂交,得到杂交二代,(2分)杂交二代自交,可以得到基因为aabbdd的种子,该种子可长成基因型为aabbdd的植株。(2分)
(可先A与C杂交得杂交一代,杂交一代再与B杂交得到杂交二代,杂交二代再自交获得所需基因型。或B与C杂交得杂交一代,杂交一代再与A杂交得到杂交二代,杂交二代再自交获得所需基因型等答案无可得分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com