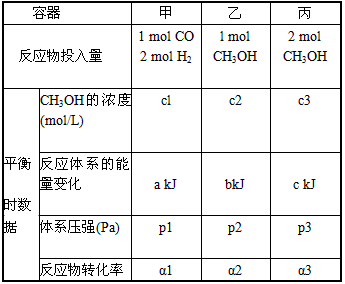
(14分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
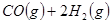

(1)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A.生成 的速率与消耗 的速率与消耗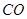 的速率相等 的速率相等 |
| B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 |
D.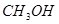 、 、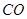 、 、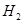 的浓度都不再发生变化 的浓度都不再发生变化 |
E. 气体的压强不再改变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
|
K
| 2.041
| 0.270
| 0.012
|
①由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
②某温度下,将
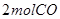
和
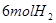
充入
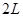
的密闭容器中,充分反应后,达到平衡时测得
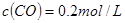
,则CO的转化率为__________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a. 升温 b. 加入催化剂 c. 增加CO的浓度
d. 恒容下加入
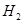
使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
(4)在250℃时,某时刻测得该温度下的密闭容器中各物质的物质的量浓度见下表:
CO
| 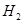
| 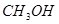
|
0.5 mol·L—1
| 2mol·L—1
| 6mol·L—1
|
此时反应的正、逆反应速率的关系是:v
(正) v
(逆)(填“大于”“小于”或“等于”)。
(5)如图1所示,甲为恒容密闭容器,乙为恒压密闭容器。在甲、乙两容器中分别充入等物质的量的H
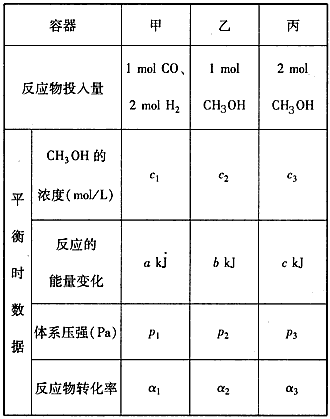
2和CO,使甲、乙两容器初始容积相等。在相同温度下发生上述反应,并维持反应过程中温度不变。已知甲容器中CO的转化率随时间变化的图像如图2所示,请在图2中画出乙容器中CO的转化率随时间变化的图像。


 。能判断该反应一定达到化学平衡状态的依据是( )
。能判断该反应一定达到化学平衡状态的依据是( )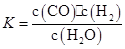 。能判断该反应一定达到化学平衡状态的依据是( )
。能判断该反应一定达到化学平衡状态的依据是( )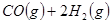

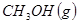
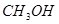 的速率与消耗
的速率与消耗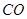 的速率相等
的速率相等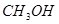 、
、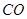 、
、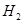 的浓度都不再发生变化
的浓度都不再发生变化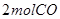 和
和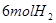 充入
充入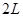 的密闭容器中,充分反应后,达到平衡时测得
的密闭容器中,充分反应后,达到平衡时测得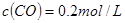 ,则CO的转化率为__________,此时的温度为__________。
,则CO的转化率为__________,此时的温度为__________。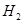 使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇
使压强变大 e. 恒容下加入惰性气体使压强变大 f. 分离出甲醇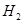
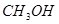

 CH3OH(g) △H
CH3OH(g) △H
 CH3OH(g) △H
CH3OH(g) △H