
题目列表(包括答案和解析)
向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
|
| ①号试管 | ②号试管 |
| 加入药品 | 草酸溶液 硫酸酸化高锰酸钾溶液 | 草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) | 溶液褪色很慢(30s) | 溶液褪色很快(2s) |
实验(2):在两支试管中分别加入5 mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5滴0.1mol·L-1的高锰酸钾溶液。现象如下(表2)
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 现象 | 100 s | 90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
实验(3):取3支试管分别加入5 mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1 mL、2 mL稀硫酸溶液,各加入5滴0.1 mol·L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象(表3)。
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间
实验现象 | 80 s | 100 s | 120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 |
(1) 该研究性学习小组的实验目的是 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫 法;
(3)实验(1)得出的结论是 。
(4)由实验(2)和实验(3)得出的结论是(写三点)
_________________________,_____________________,_______________;
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
H2C2O4+ MnO4—+ = Mn2++ + H2O
向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0.1 mol·L-1的硫酸酸化高锰酸钾溶液。现象如下(表1)
| | ①号试管 | ②号试管 |
| 加入药品 | 草酸溶液 硫酸酸化高锰酸钾溶液 | 草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) | 溶液褪色很慢(30s) | 溶液褪色很快(2s) |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 现象 | 100 s | 90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 实验现象 | 80 s | 100 s | 120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |||
| | ①号试管 | ②号试管 |
| 加入药品 | 草酸溶液 硫酸酸化高锰酸钾溶液 | 草酸溶液 硫酸酸化高锰酸钾溶液 硫酸锰固体 |
| 实验现象(褪色时间) | 溶液褪色很慢(30s) | 溶液褪色很快(2s) |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 现象 | 100 s | 90 s |
| 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | ||
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 实验现象 | 80 s | 100 s | 120 s |
| 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色。 | |||
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
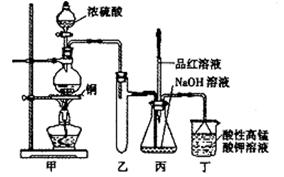
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
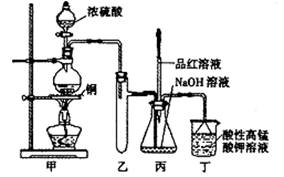
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com