
题目列表(包括答案和解析)
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| | ① | H2(g)+ O2(g)= H2O(g) △H =﹣242kJ/mol; O2(g)= H2O(g) △H =﹣242kJ/mol; | ||||||||
| | ② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | ||||||||
| | ③ | C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; | ||||||||
| | ④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | ||||||||
| | ⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL | ||||||||
| 化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | | ||
| 键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | | ||
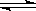 H2(g)+ CO(g)△H =" ___________" kJ/moL;
H2(g)+ CO(g)△H =" ___________" kJ/moL; 下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量得KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、(5分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)![]() 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
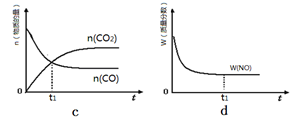
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到
t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) ![]() N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
。
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+
N2(g)。△H<0
2CO2(g)+
N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。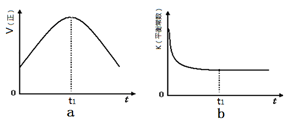
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)  N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0

 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com