
题目列表(包括答案和解析)
科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的.”利用盖斯定律可测某些特别反应的热效应.已知:
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2983.2 kJ/mol
P(s,红磷)+![]() O2(g)=
O2(g)=![]() P4O10(s) ΔH2=-738.5 kJ/mol
P4O10(s) ΔH2=-738.5 kJ/mol
则白磷的稳定性比红磷________(填“高”或“低”),理由是________.
(1)已知:N2(g)+2O2(g)ƒ2NO2(g)△H=67.7kJ/mol,
N2H4(g)+O2(g)ƒN2(g)+2H2O(g)△H=-534kJ/mol
由盖斯定律可计算出1mol N2H4和NO2完全反应生成N2和H2O(g)时放出的热量为kJ。该反应的热化学方程式为________。
(2)使m(g)SO2和n(g)S在碱性溶液中作用,恰好完全反应生成S2O32-;若先使n(g)S在碱性溶液中发生反应,生成Sx2-和S2O32-,然后通入m(g)SO2也生成S2O32-。各反应都在相同条件下进行。两种途径的反应热是否相同?________,两种途径生成S2O32-的物质的量是否相同?________。
1840年盖斯提出了盖斯定律,不管化学反应是一步完成还是分步完成,这个过程的热效应是相等的,而与过程无关。
(1)已知:N2(g)+2O2(g)ƒ2NO2(g)△H=67.7kJ/mol,
N2H4(g)+O2(g)ƒN2(g)+2H2O(g)△H=-534kJ/mol
由盖斯定律可计算出1mol N2H4和NO2完全反应生成N2和H2O(g)时放出的热量为kJ。该反应的热化学方程式为________。
(2)使m(g)SO2和n(g)S在碱性溶液中作用,恰好完全反应生成S2O32-;若先使n(g)S在碱性溶液中发生反应,生成Sx2-和S2O32-,然后通入m(g)SO2也生成S2O32-。各反应都在相同条件下进行。两种途径的反应热是否相同?________,两种途径生成S2O32-的物质的量是否相同?________。
(6分)(1)已知拆开1molH-H键,lmolN-H键,1mol 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。已知:
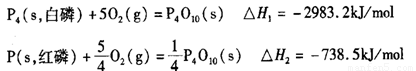
则白磷的稳定性比红磷_____________(填“高”或“低”),理由是________________
__________________________________________________________________________。
 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com