我市某校初三化学学习小组的同学前往某地的石灰石矿区进行调查,他们取回矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:
甲组同学:
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO
2的体积,再根据体积换算为质量,最后根据CO
2的质量求出样品中碳酸钙的质量.图1为大理石与稀盐酸反应的反应装置,并测量CO
2的体积.(其他仪器省略)
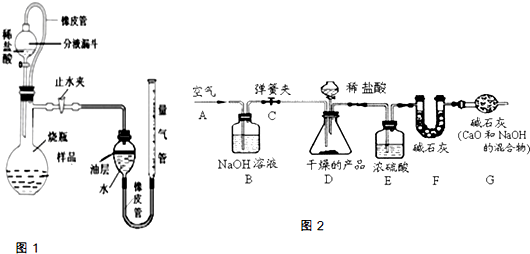
(1)图中左侧的橡皮管的作用
使分液漏斗和烧瓶内的气压始终保持平衡防止测得气体体积有误差
使分液漏斗和烧瓶内的气压始终保持平衡防止测得气体体积有误差
(2)图中装置中油层的作用是
隔绝CO2和水,防止CO2溶于水并和水反应
隔绝CO2和水,防止CO2溶于水并和水反应
(3)
反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平
反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平
(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
乙组同学:
【查阅资料】1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分取样品,研成粉状后,按图2进行实验.
(1)实验步骤:
①连接好装置,检查气密性; ②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量F的质量; ④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次快速通一段时间空气;⑥称量F的质量,计算前后两次质量差.最后根据CO
2的质量求出样品中碳酸钙的质量
(2)问题探究:①产品研成粉的目的
增大与盐酸的接触面积加快反应速率,使反应进行的更充分
增大与盐酸的接触面积加快反应速率,使反应进行的更充分
;
②B装置的作用是
吸收除去空气中的二氧化碳,以免对实验干扰
吸收除去空气中的二氧化碳,以免对实验干扰
;G装置的作用是
防止空气中二氧化碳和水份进入F中以免对实验干扰
防止空气中二氧化碳和水份进入F中以免对实验干扰
,
③若没有E装置,则测定的CaCO
3的质量分数会
偏大
偏大
(填“偏大”、“偏小”、“不变”).
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的
排除装置内空气中二氧化碳气体,使装置中的CO2全部被碱石灰吸收,以免对实验干扰
排除装置内空气中二氧化碳气体,使装置中的CO2全部被碱石灰吸收,以免对实验干扰
总结反思:(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因
二氧化碳溶于水中
二氧化碳溶于水中
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因
步骤⑤中快速通空气使空气中二氧化碳没有吸收完全
步骤⑤中快速通空气使空气中二氧化碳没有吸收完全
.

 19、特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图示回答:
19、特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图示回答: 实验室常用氯酸钾与二氧化锰的混合物来制取氧气,二氧化锰能加快氯酸钾的分解,现设计实验证明氧化铜也能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较(即比较反应的快慢).用如图装置进行实验,实验时均以生成25mL气体为准,其他可能影响实验的因素已忽略,相关数据见下表:
实验室常用氯酸钾与二氧化锰的混合物来制取氧气,二氧化锰能加快氯酸钾的分解,现设计实验证明氧化铜也能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较(即比较反应的快慢).用如图装置进行实验,实验时均以生成25mL气体为准,其他可能影响实验的因素已忽略,相关数据见下表: