
题目列表(包括答案和解析)
某学习小组用如图所示装置测定锌铜合金中铜的质量分数。(已知:金属与酸时放出一定的热量)

(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是 ;
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②待B中不再有气体产生并恢复至室温后,记录C的液面位置;③由A向B滴加足量试剂;④检查气密性。
上述再进行的操作的顺序是 (填序号);
(3)该装置的气密性的检验方法是打开分液漏斗旋塞,从D管注入经济易得的 ,使U型管左右液面相平,关闭分液漏斗旋塞,提高D管, ,说明装置的气密性好;
(4)待B中不再有气体产生,记录C的液面位置前,需将温度恢复至室温和 ;
(5)若实验用锌铜合金的质量为ag,与稀硫酸充分反应后,测得氢气体积为V L,为求出合金中铜的质量分数,还缺少的一个数据是 ;
A.反应前加入稀硫酸的体积 B.反应前加入稀硫酸的质量分数
C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
(6)若a为0.4g,V为80mL,求合金中铜的质量分数。(在实验条件下,H2的密度为0.09g/L,5分)
(7)实验过程中,若未冷却就读取气体体积,则测得锌的质量分数将 (填 “偏大”、“偏小”或“不受影响”)。
(8)可指导老师认为,利用上述实验装置,测量结果总会偏小,原因是 ,改进方法是 。
【解析】(1) 先将锌铜合金在稀酸中浸泡片刻,其目的是除去表面氧化物(2)根据实验操作的步骤进行解答(3)根据装置的气密性的检验方法进行解答(5)根据质量=体积乘以密度进行解答(6)由题可知氢气的质量,根据化学方程式求得锌的质量,可求得铜的质量分数(7) 未冷却氢气体积偏大,即氢气的质量偏大,求得锌的质量分数将偏大,(8)根据能影响生成气体体积的因素进行解答
通过学习化学,相信你已经初步掌握了实验室制取气体的有关知识。请结合图示回答问题。
A B C D E F
(1)写出图中标示的仪器名称:② 。
(2)注射器A可用于检查装置C的气密性,步骤如下:
①向锥形瓶中加入少量水至 处。
②将注射器A连接到装置C的橡胶管(或导管口)处。
③缓慢拉动注射器A的活塞,观察到 ,表示装置C的气密性良好。
(3)实验室用加热氯酸钾与二氧化锰混合物的方法制取氧气,应选择的发生装置和收集装置是 ,写出该反应的文字表达式 。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除Mn02、CuO外,Fe203也可以作KCl03分解的催化剂。
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KCl03 | 580 |
| ② | KCl03、Mn02(质量比1:1) | 350 |
| ③ | KCl03、CuO(质量比l:1) | 370 |
| ④ | KCl03、Fe203(质量比1:1) | 390 |
通过学习化学,相信你已经初步掌握了实验室制取气体的有关知识。请结合图示回答问题。
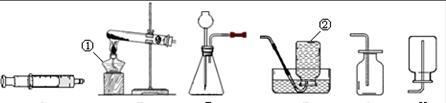
A B C D E F
(1)写出图中标示的仪器名称:② 。
(2)注射器A可用于检查装置C的气密性,步骤如下:
①向锥形瓶中加入少量水至 处。
②将注射器A连接到装置C的橡胶管(或导管口)处。
③缓慢拉动注射器A的活塞,观察到 ,表示装置C的气密性良好。
(3)实验室用加热氯酸钾与二氧化锰混合物的方法制取氧气,应选择的发生装置和收集装置是 ,写出该反应的文字表达式 。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除Mn02、CuO外,Fe203也可以作KCl03分解的催化剂。
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
|
实验编号 |
实验药品 |
分解温度(℃) |
|
① |
KCl03 |
580 |
|
② |
KCl03、Mn02(质量比1:1) |
350 |
|
③ |
KCl03、CuO(质量比l:1) |
370 |
|
④ |
KCl03、Fe203(质量比1:1) |
390 |
【分析数据、得出结论】(1)由实验____________与实验④对比,证明猜想合理
(2)实验所用的三种金属氧化物,催化效果最好的是_____________________。
【反思】(1)若要证明Fe203是该反应的催化剂,还要验证它在化学反应前后的质量和___不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证___________ 。
【整理实验台】实验结束后,对实验仪器进行清洗。大试管清洗干净的标志是 。

| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KCl03 | 580 |
| ② | KCl03、Mn02(质量比1:1) | 350 |
| ③ | KCl03、CuO(质量比l:1) | 370 |
| ④ | KCl03、Fe203(质量比1:1) | 390 |
已知某纯碱粗产品仅含有NaCl杂质,为测定该纯碱粗产品中纯碱的质量分数,某兴趣小组的同学设计了下图所示的实验装置,取10.0 g粗产品进行实验。

【说明】碱石灰是CaO与NaOH 的固体混合物,能吸收水和二氧化碳。E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为NaHCO3 十HC1 = NaCl十CO2↑十H2O。
实验主要操作步骤如下:
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量 G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量 G的质量,测得质量增加了0.48 g。
请回答下列问题
(1)F中的试剂应为___________________________。
(2)B装置的作用是__________________________,B装置中发生反应的化学方程式为:
____________________________________________________________________________
(3)H装置的作用是 。
(4)事实上10.0 g粗产品只能产生0.40g CO2。请你仔细分析上述实验,解释G的质量增加了0.48 g的原因(假设操作均正确) 。
一、选择题:(共30分)
一
题号
1
2
3
4
5
6
7
8
答案
D
D
D
B
B
C
C
D
题号
9
10
11
12
13
14
15
答案
A
B
C
B
C
C
A
二、填空题:(共30分)
16、(2分)2PbO?PbO2 ,Pb2(PbO4)或Pb(PbO2)2
17、(3分)CO+PdCl2+H2O==2HCl+Pd+CO2;还原。
18、(3分)(1)燃烧产物中存在CO2;⑵存在;中的澄清石灰水变浑浊。
19、(2分)将肥皂水分别逐滴滴入这四种待测溶液并振荡,根据肥皂水滴入后开始产生泡沫时的不同滴数来区分 。
20、(2分)挥发出来的HCl进入石灰水,与Ca(OH)2作用而阻碍了CO2与Ca(OH)2的作用 (1分) ;CO2与生成的CaCO3作用,生成Ca(HCO3)2 (1分 )。
21、(2分)Si3N4 ;H2SiO3。
22、(6分)⑴用玻璃棒把待测溶液滴在一张pH试纸上,并约一分钟内把试纸显示的颜色跟比色卡对照; ⑵碱;酸。⑶洗发;护发。
23、(6分)
⑴ ① H2S+Na2CO3=NaHCO3+NaHS ;② NaHS+RNO+H2O=S↓+NaOH+RNHOH ;
③ NaOH+Na HCO3=Na2CO3+H2O ;④ 2RNHOH+O2=2RNO+2H2O
⑵ 2H2S+O2=2S↓+2H2O;催化
三、实验题:(共29分)
24、(11分)⑴除去鼓入空气中的二氧化碳;防止空气中的二氧化碳和水进入B中影响实验结果;防止D中的水蒸气进入B中;用除去二氧化碳的空气赶走体系中的二氧化碳;用除去二氧化碳的空气将反应产生的二氧化碳 全部赶入B中; 不能 ,①空气中含少量二氧化碳、②反应后装置中残留二氧化碳均会造成结论偏差。⑵ 43.4 ;95.4% 。
25、(12分) (1) 乙;因为铁是化学性质较活泼的金属,尤其是铁粉颗粒小,常温下更易与空气中的氧气、水蒸气反应而生锈。 (2)
实验步骤
预期的实验现象
结论
①用磁铁充分接触滤纸上的脱氧剂粉末
绝大部分黑色粉末被吸引
脱氧剂的成分是铁粉
②将红色物质放入小试管中,加入足量稀硫酸观察现象。继续滴加足量的NaOH溶液。
红色物质溶解,溶液呈黄棕色,产生红褐色沉淀
红色物质是Fe203
此项可有多种答案,只要原理正确,各项叙述清楚,能确定铁粉及氧化铁的存在,均可给分。
(3) Fe203 + 3H2SO4 = Fe2( SO4 )3十3H2O
Fe2( SO4 )3 + 6NaOH === 2Fe (OH)3↓+3Na2 SO4
26、(6分) 换一根长的导管,并用湿毛巾包住导管,然后再在导管的另一端做点火试验。
⑷导管口同样能点燃,去掉毛巾,导内壁看不到冷凝的固体;
导管口不能点燃,去掉毛巾,导管内壁可看到有冷凝的固体
导管口能点燃,但火焰较小,去掉毛巾,导管内壁能看到冷凝的固体。
⑸2CnH2n+2+(3n+1)O2 点燃 2nCO2+(2n+2) H2O
四、计算题
27、 (l)84.8%,
实验次数
每次产生的CO2的质量(g)
第一次先逐滴加盐酸100g
0
第二次再逐滴加盐酸100g
第三次再逐滴加盐酸100g
②关系图。
.files/image007.gif) CO2
CO2
.files/image008.gif) |
.files/image009.gif)
.files/image010.gif)
.files/image011.gif) 质量/g
质量/g
8.8
0 100 200 300 稀盐酸质量/g
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com