
题目列表(包括答案和解析)
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
|
序号 |
A |
B |
C |
|
装置 |
|
|
|
|
原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。
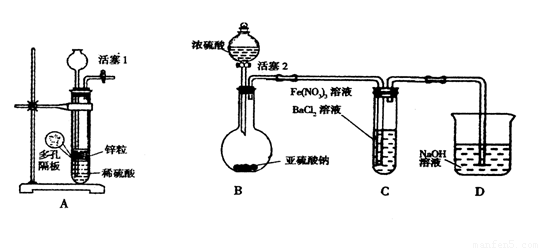
(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
|
实验步骤 |
预期现象和结论 |
|
|
|
Fe(NO3)3溶液
Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯( )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| | 熔点 ℃ | 沸点 ℃ | 水溶性 |
| 甲醇 | —97.8 | 64.7 | 易溶 |
| 苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
| 苯甲酸甲酯 | —12.3 | 198 | 难溶 |





Ⅰ.(1)已知某有机物A只含有C、H、O三种元素,通过元素分析知含碳54.55%,含氢9.10%。质谱分析其相对分子质量为88,经红外光谱分析其中只含C-H键和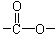 键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
键,其核磁共振氢谱图显示有三重峰,峰面积之比为3:2:3,该有机物不含有CH3-O-,则A的结构简式为
_______________。
(2)写出实验室制备A的化学方程式_________________________________________。
Ⅱ.苯甲酸甲酯(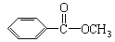 )是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠(
)是常用香精,广泛用于食品、化妆品等行业,可从自然界中提取,也可人工合成。实验室现以食品防腐剂[主要成分为苯甲酸钠( )]、甲醇为原料制备苯甲酸甲酯。已知:
)]、甲醇为原料制备苯甲酸甲酯。已知:
| 熔点 ℃ | 沸点 ℃ | 水溶性 |
甲醇 | —97.8 | 64.7 | 易溶 |
苯甲酸(一元弱酸) | 122.4 | 249.3 | 常温:0.17g;100℃:6.8g |
苯甲酸甲酯 | —12.3 | 198 | 难溶 |
合成苯甲酸甲酯的流程如下:

请回答下列问题:
(1)温度①约为_________℃,操作③为_________,操作④为__________。
(2)第②步加热的目的是______________________________________。
(3)选择合适的制备苯甲酸甲酯的装置:______________。
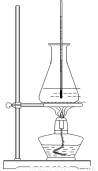
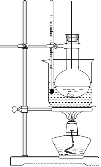
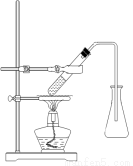
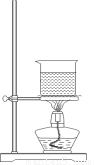
A B C D
(4)苯甲酸甲酯有多种同分异构体,写出符合下列条件的任意一种同分异构体的结构简式_______。①为芳香化合物 ②含有醛基 ③能与金属Na反应
Ⅰ.(1)硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请简要说明原因______________________,如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
(2)稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的化学反应______________________________________________
Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.将溶液转移至250 mL容量瓶中,加水至刻度线;
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙作指示剂;
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解;
D.将物质的量浓度为m mol•L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度数为V1 mL;
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点消耗酸的体积V2 mL。
回答下列问题:
(1)正确的操作步骤的顺序是(填写字母)
________→________→________→________→________;
(2)终点到达的现象是________________________;
(3)若酸式滴定管没有用标准H2SO4润洗,对测定结果影响________,滴定前仰视读数滴定后俯视读数对测定结果影响________ ;(填“偏高”、“偏低”或“无影响”,其他操作均正确)。
(4)该烧碱的百分含量是________。
B.[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
| 甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。
一 二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
A
D
B
B
A
D
D
题号
9
10
11
12
13
14
答案
D
BD
CD
C
AD
AC
15.(1)防止暴沸 冷凝回流
(2)3.2
(3)温度过高发生副反应。
(4)除去产物中的丁醇。(每空2分)
16.(1)SO2
(1分) 
 (1分) (2)第四周期第Ⅷ族(2分)
(1分) (2)第四周期第Ⅷ族(2分)
(3)2Al+Fe2O3 Al2O3+2Fe (2分) 0.1 mol (1分)
Al2O3+2Fe (2分) 0.1 mol (1分)
(4) ③(1分)
(5) 3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O(2分)
(6) Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O(2分)
2K2FeO4+3KNO2+2H2O(2分)
17.(共8分)
(1)0.075mol/L?min(1分)
(2)放热, CO(g)+2H2(g) → CH3OH(g) +91KJ, 不能(各1分,共3分)
(3)K = ,减小;(各1分,共2分) (4)c(2分)
18.
(1)反应速率突然减小(或铁片表面生成的气泡突然减少)(2分)
(2)过滤(1分)
(3)b、d(2分),Fe和Cu(1分)
(4)抑制Fe2+、NH4+水解(2分)
(5)避免加热过程中晶体受热分解(或被氧化)(2分)
19.(每空2分)
(1) 氧化还原反应 (2)
氧化还原反应 (2)
(3)C10H12O4
(4)
20.(每空2分,共10分)
(1)2.8×105 ;18
(2)86.96%
(3) ;138
;138
21.A(1)●:AlF6- ○:Na+ AlF6- 电解炼铝的助熔剂(各1分)
(2).H2O2分子间存在氢键(1分),与水分子可形成氢键(1分)。
(3)3d104s1(1分) Cr(1分) 共价键、配位键(2分)
降低Cu(NH3)4SO4?H2O的溶解度(2分)
B.(1) Fe + 2H+ → Fe2+ + H2↑;CuO + 2H+ → Cu2+ + H2O (各2分)
(2) ① (1分)
(3) ③ (1分)
(4) ①③ (2分)
(5) ②④① (2分)
(6)二; (1+3分)
(1+3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com